- Головна
- Готові шкільні презентації
- Презентація на тему «основи термодинаміки» (варіант 1)
Презентація на тему «основи термодинаміки» (варіант 1)
1436
Слайд #1
основи термодинаміки
Термодинаміка — теорія теплових процесів, у яких не враховується молекулярна будова, а теплові явища описуються макроскопічними параметрами і реєструються приладами.
Термодинаміка — теорія теплових процесів, у яких не враховується молекулярна будова, а теплові явища описуються макроскопічними параметрами і реєструються приладами.

Слайд #2
Внутрішня енергія тіла — сума кінетичної енергії теплового (хаотичного) руху молекул тіла та потенціальної енергії їх взаємодії. .
Практика і наукові дослідження переконують, що зміна внутрішньої енергії може відбуватись в результаті виконання роботи або внаслідок теплопередачі
Практика і наукові дослідження переконують, що зміна внутрішньої енергії може відбуватись в результаті виконання роботи або внаслідок теплопередачі

Слайд #3
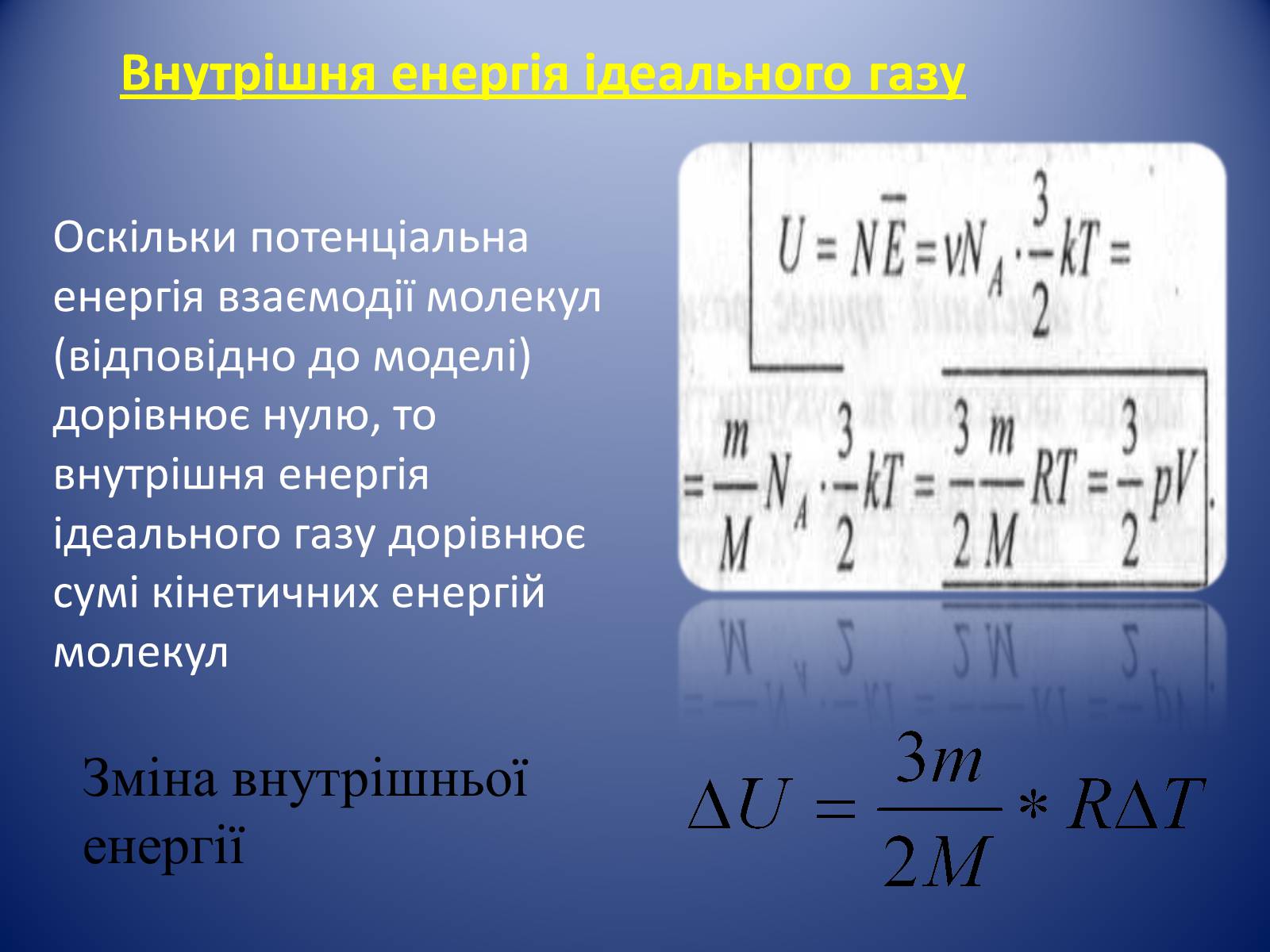
Внутрішня енергія ідеального газу
Оскільки потенціальна енергія взаємодії молекул (відповідно до моделі) дорівнює нулю, то внутрішня енергія ідеального газу дорівнює сумі кінетичних енергій молекул
Зміна внутрішньої енергії
Оскільки потенціальна енергія взаємодії молекул (відповідно до моделі) дорівнює нулю, то внутрішня енергія ідеального газу дорівнює сумі кінетичних енергій молекул
Зміна внутрішньої енергії
Слайд #4
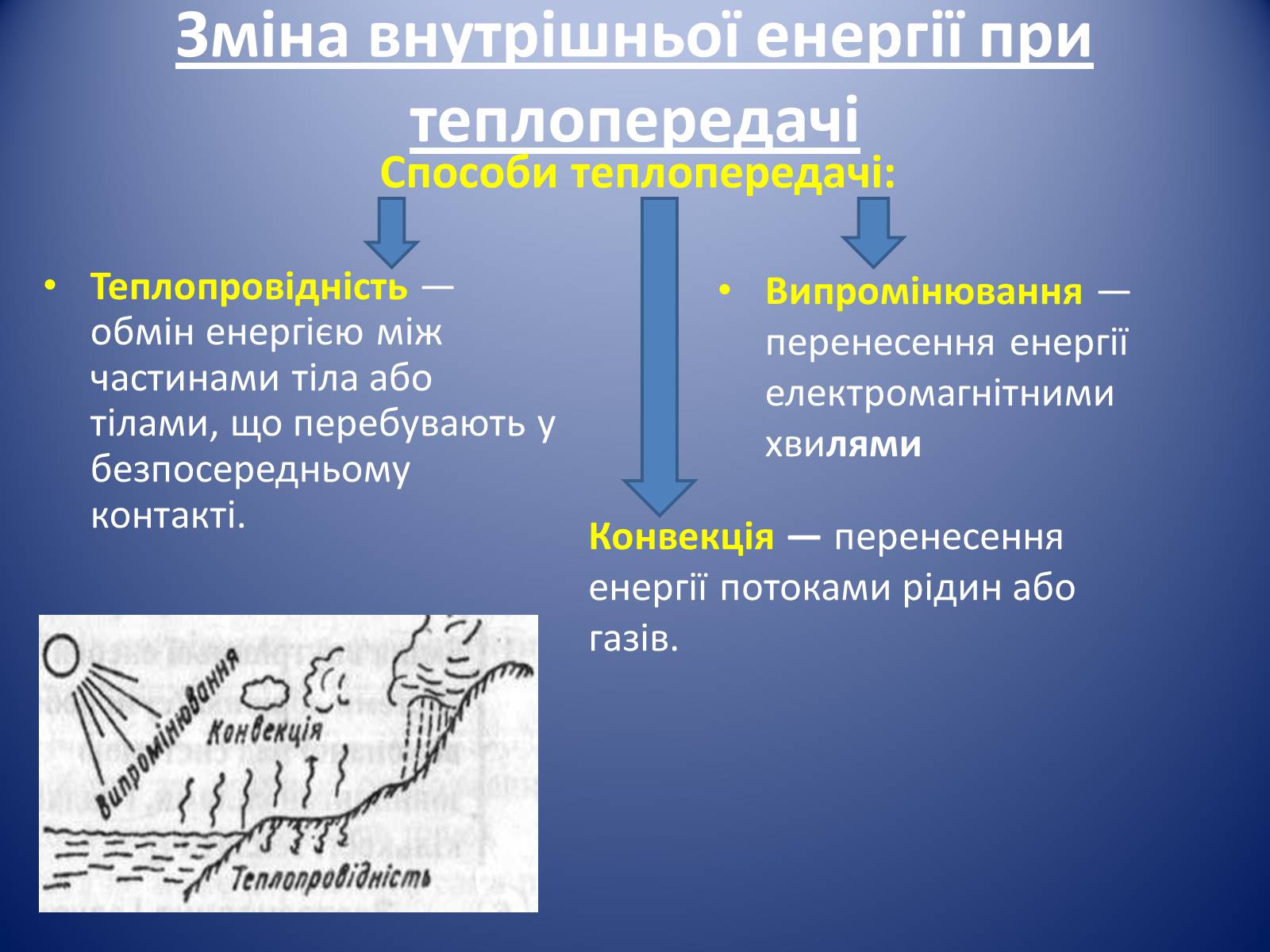
Зміна внутрішньої енергії при теплопередачі
Способи теплопередачі:
Теплопровідність — обмін енергією між частинами тіла або тілами, що перебувають у безпосередньому контакті.
Конвекція — перенесення енергії потоками рідин або газів.
Випромінювання — перенесення енергії електромагнітними хвилями
Способи теплопередачі:
Теплопровідність — обмін енергією між частинами тіла або тілами, що перебувають у безпосередньому контакті.
Конвекція — перенесення енергії потоками рідин або газів.
Випромінювання — перенесення енергії електромагнітними хвилями
Слайд #5
Енергію, яку передано тілу (чи відібрано від нього) внаслідок теплопередачі, називають кількістю теплоти Q. ∆U = Q .
Формули для розрахунку кількості теплоти при:
нагріванні і охолодженні тіл: Q = cm(t2 –t1) Q = ст(Т2 –T1) .
плавленні і твердненні речовин: Q = ±λ т.
пароутворенні і конденсації: Q= ±Lт.
згорянні речовини: Q = qm.
Формули для розрахунку кількості теплоти при:
нагріванні і охолодженні тіл: Q = cm(t2 –t1) Q = ст(Т2 –T1) .
плавленні і твердненні речовин: Q = ±λ т.
пароутворенні і конденсації: Q= ±Lт.
згорянні речовини: Q = qm.

Слайд #6
Зміна внутрішньої енергії при виконанні роботи
Механічна робота (подолання тертя, деформація дроблення тіл тощо): ∆ U = А , А = Fscosa .
Механічна робота
Робота в термодинаміці
Механічна робота (подолання тертя, деформація дроблення тіл тощо): ∆ U = А , А = Fscosa .
Механічна робота
Робота в термодинаміці

Слайд #7
2. Робота в термодинаміці:
1) при ізобарному розширенні газу Аг= Fгscosa,
Fг=pS, S = ∆L = L2-L1.
Отже,
Аг= pS∆L = р∆V = Р(V1-V2)
2)tпри ізохорному процесі: А=0.
3)tдовільний процес розширення газуможна зобразити як сукупність послідовних ізобарних та ізохорних процесів.
А г= Sкрив.трап.
Робота чисельно рівна площі під графіком.
1) при ізобарному розширенні газу Аг= Fгscosa,
Fг=pS, S = ∆L = L2-L1.
Отже,
Аг= pS∆L = р∆V = Р(V1-V2)
2)tпри ізохорному процесі: А=0.
3)tдовільний процес розширення газуможна зобразити як сукупність послідовних ізобарних та ізохорних процесів.
А г= Sкрив.трап.
Робота чисельно рівна площі під графіком.

Слайд #8
Перший закон термодинаміки За законом збереження енергії ∆ U = Q + А або Q = ∆U+A' , бо А'= -А.
Зміна внутрішньої енергії ∆ U системи дорівнює сумі роботи А, виконаної над системою зовнішніми силами, і наданої їй кількості теплоти Q. ∆ U = Q + А
Кількість теплоти Q, що надана системі, йде на збільшення її внутрішньої енергії ∆ U і виконання системою роботи А' проти зовнішніх сил. Q = ∆U+A'
Зміна внутрішньої енергії ∆ U системи дорівнює сумі роботи А, виконаної над системою зовнішніми силами, і наданої їй кількості теплоти Q. ∆ U = Q + А
Кількість теплоти Q, що надана системі, йде на збільшення її внутрішньої енергії ∆ U і виконання системою роботи А' проти зовнішніх сил. Q = ∆U+A'

Слайд #9
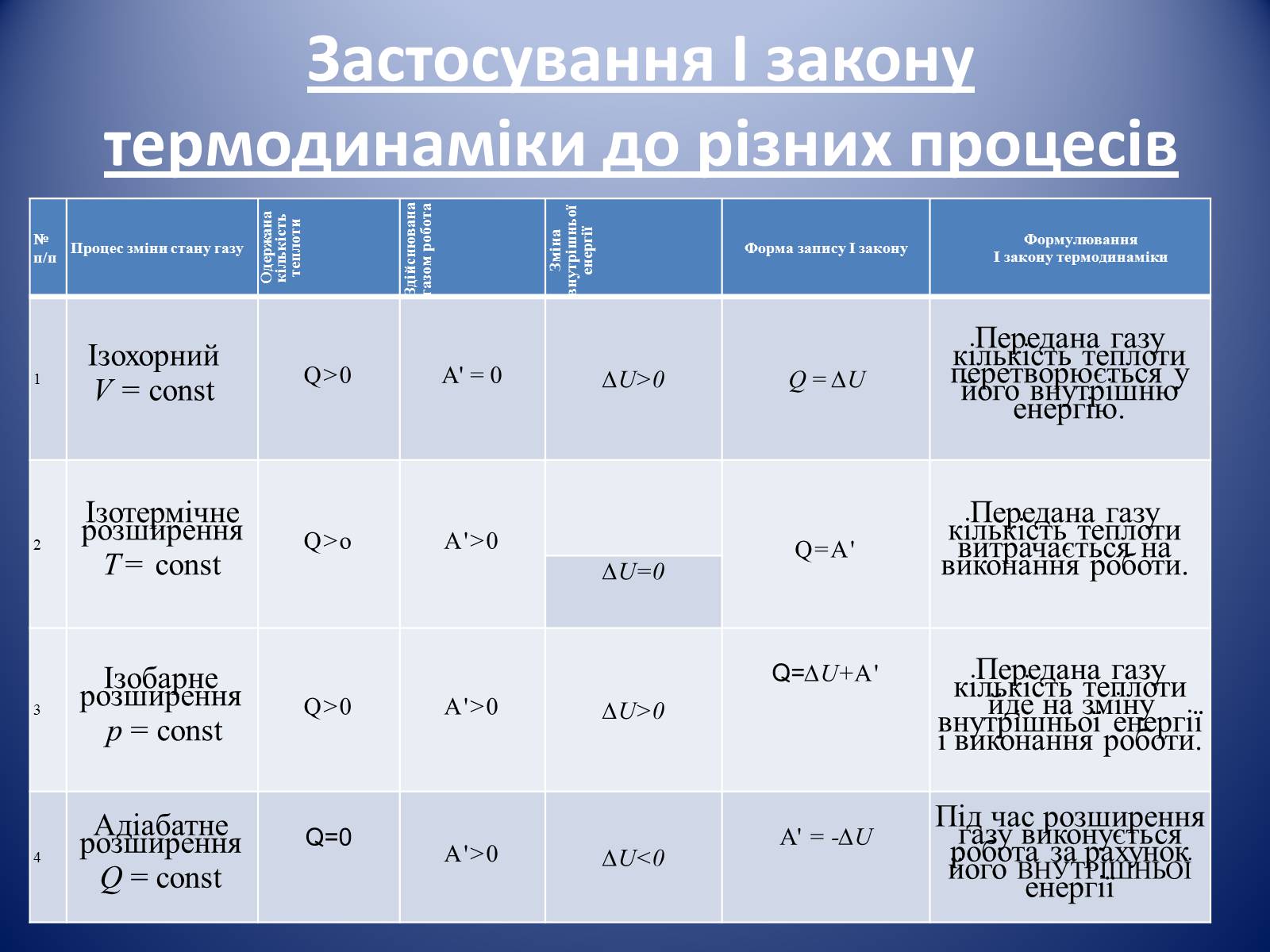
Застосування І закону термодинаміки до різних процесів
№
п/п
Процес зміни стану газу
Одержана кількість теплоти
Здійснювана газом робота
Зміна внутрішньої енергії
Форма запису І закону
Формулювання
І закону термодинаміки
1
Ізохорний
V = const
Q>0
A' = 0
∆U>0
Q = ∆U
Передана газу кількість теплоти перетворюється у його внутрішню енергію.
2
Ізотермічне розширення
Т= const
Q>о
А'>0
Q=А'
Передана газу кількість теплоти витрачається на виконання роботи.
∆U=0
3
Ізобарне розширення
р = const
Q>0
A'>0
∆U>0
Q=∆U+А'
Передана газу кількість теплоти йде на зміну внутрішньої енергії і виконання роботи.
4
Адіабатне розширення
Q = const
Q=0
А'>0
∆U<0
A' = -∆U
Під час розширення газу виконується робота за рахунок
його внутрішньої енергії
№
п/п
Процес зміни стану газу
Одержана кількість теплоти
Здійснювана газом робота
Зміна внутрішньої енергії
Форма запису І закону
Формулювання
І закону термодинаміки
1
Ізохорний
V = const
Q>0
A' = 0
∆U>0
Q = ∆U
Передана газу кількість теплоти перетворюється у його внутрішню енергію.
2
Ізотермічне розширення
Т= const
Q>о
А'>0
Q=А'
Передана газу кількість теплоти витрачається на виконання роботи.
∆U=0
3
Ізобарне розширення
р = const
Q>0
A'>0
∆U>0
Q=∆U+А'
Передана газу кількість теплоти йде на зміну внутрішньої енергії і виконання роботи.
4
Адіабатне розширення
Q = const
Q=0
А'>0
∆U<0
A' = -∆U
Під час розширення газу виконується робота за рахунок
його внутрішньої енергії
Слайд #10
Адіабатний процес — це процес без теплообміну із зовнішнім середовищем (система або теплоізольована, або процес дуже швидкий).
Приклади: стиск повітря в дизельному двигуні, розширення пари шампанського вина при вильоті корка, розширення нагрітого повітря при підніманні у верхні шари атмосфери.
Приклади: стиск повітря в дизельному двигуні, розширення пари шампанського вина при вильоті корка, розширення нагрітого повітря при підніманні у верхні шари атмосфери.

Слайд #11
Другий закон термодинаміки.Необоротність теплових процесів
Повний перехід кількості теплоти, яку дістає система, в механічну роботу неможливий. Численні досліди показують, що частина енергії розсіюється, тобто частина кількості теплоти передається від більш нагрітого тіла (нагрівника) до менш нагрітого.
Отже, неможливий процес, єдиним результатом якого було б перетворення всієї теплоти, одержаної від нагрівника, в еквівалентну їй роботу. (Формулювання IIзакону термодинаміки за М. Планком).
Неможливо побудувати такий двигун, робоче тіло якого, здійснюючи періодичний процес, виконувало б роботу за рахунок охолодження певного джерела теплоти (наприклад, води в океані, земної кори тощо).
Теплові процеси необоротні. Теплота не може переходити сама по собі від тіла менш нагрітого до тіла більш нагрітого. (Формулювання II закону термодинаміки за К. Клаузіусом).
Повний перехід кількості теплоти, яку дістає система, в механічну роботу неможливий. Численні досліди показують, що частина енергії розсіюється, тобто частина кількості теплоти передається від більш нагрітого тіла (нагрівника) до менш нагрітого.
Отже, неможливий процес, єдиним результатом якого було б перетворення всієї теплоти, одержаної від нагрівника, в еквівалентну їй роботу. (Формулювання IIзакону термодинаміки за М. Планком).
Неможливо побудувати такий двигун, робоче тіло якого, здійснюючи періодичний процес, виконувало б роботу за рахунок охолодження певного джерела теплоти (наприклад, води в океані, земної кори тощо).
Теплові процеси необоротні. Теплота не може переходити сама по собі від тіла менш нагрітого до тіла більш нагрітого. (Формулювання II закону термодинаміки за К. Клаузіусом).

Слайд #12
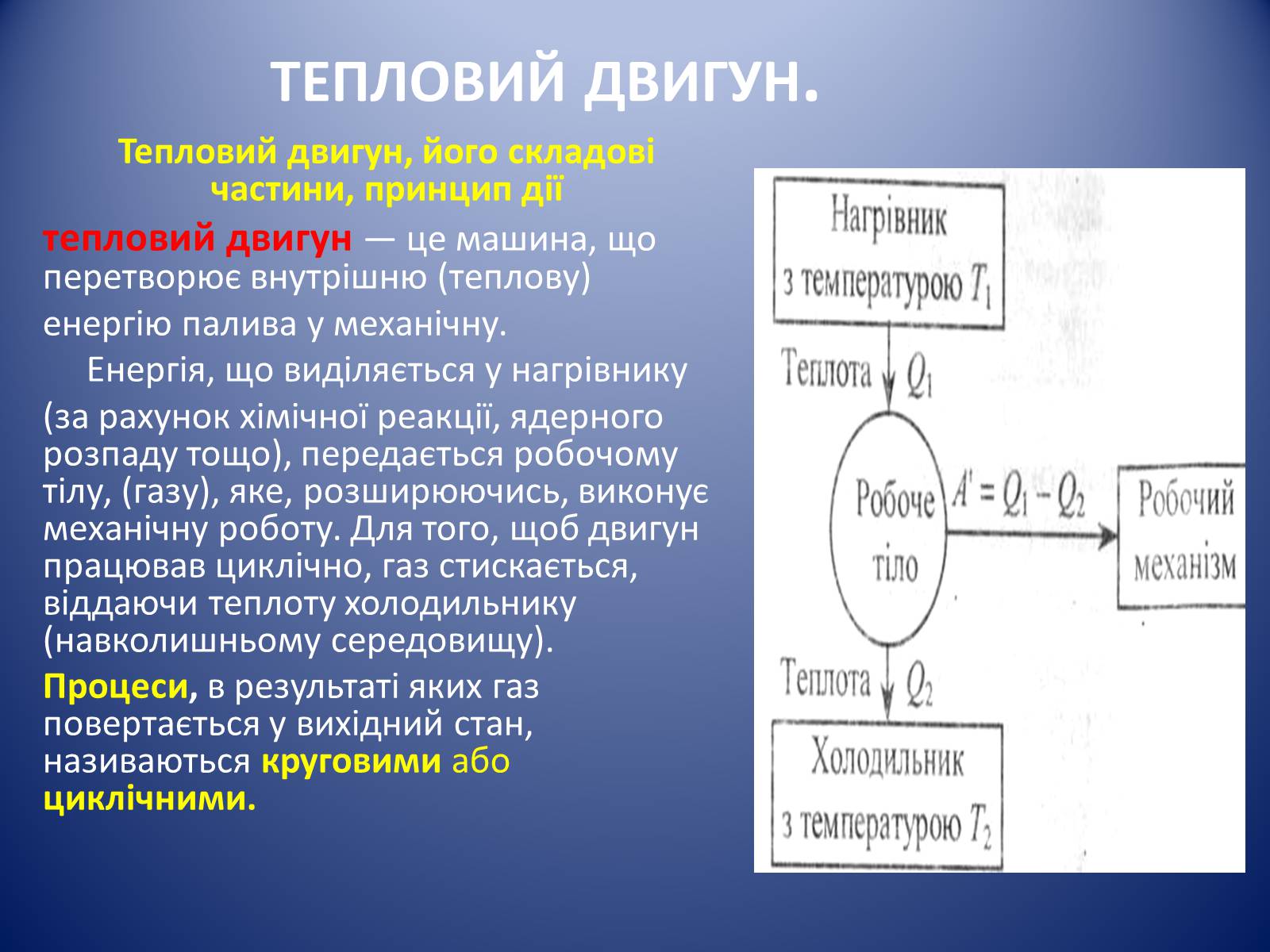
тепловий двигун.
Тепловий двигун, його складові частини, принцип дії
тепловий двигун — це машина, що перетворює внутрішню (теплову)
енергію палива у механічну.
Енергія, що виділяється у нагрівнику
(за рахунок хімічної реакції, ядерного розпаду тощо), передається робочому тілу, (газу), яке, розширюючись, виконує механічну роботу. Для того, щоб двигун працював циклічно, газ стискається, віддаючи теплоту холодильнику (навколишньому середовищу).
Процеси, в результаті яких газ повертається у вихідний стан, називаються круговими або циклічними.
Тепловий двигун, його складові частини, принцип дії
тепловий двигун — це машина, що перетворює внутрішню (теплову)
енергію палива у механічну.
Енергія, що виділяється у нагрівнику
(за рахунок хімічної реакції, ядерного розпаду тощо), передається робочому тілу, (газу), яке, розширюючись, виконує механічну роботу. Для того, щоб двигун працював циклічно, газ стискається, віддаючи теплоту холодильнику (навколишньому середовищу).
Процеси, в результаті яких газ повертається у вихідний стан, називаються круговими або циклічними.
Слайд #13
Висновки:
ККД визначається лише Т1і Т2 і не залежить від роду робочої речовини.
Способи підвищення ККД: а) збільшити Т1 зменшити Т2
б)tзбільшити тиск робочого тіла.
в)tдобитись повнішого згоряння палива;
г)tзменшити тертя.
3. ККД < 1. Якщо Т1 = Т2 — двигун не працює.
ККД визначається лише Т1і Т2 і не залежить від роду робочої речовини.
Способи підвищення ККД: а) збільшити Т1 зменшити Т2
б)tзбільшити тиск робочого тіла.
в)tдобитись повнішого згоряння палива;
г)tзменшити тертя.
3. ККД < 1. Якщо Т1 = Т2 — двигун не працює.

Слайд #14
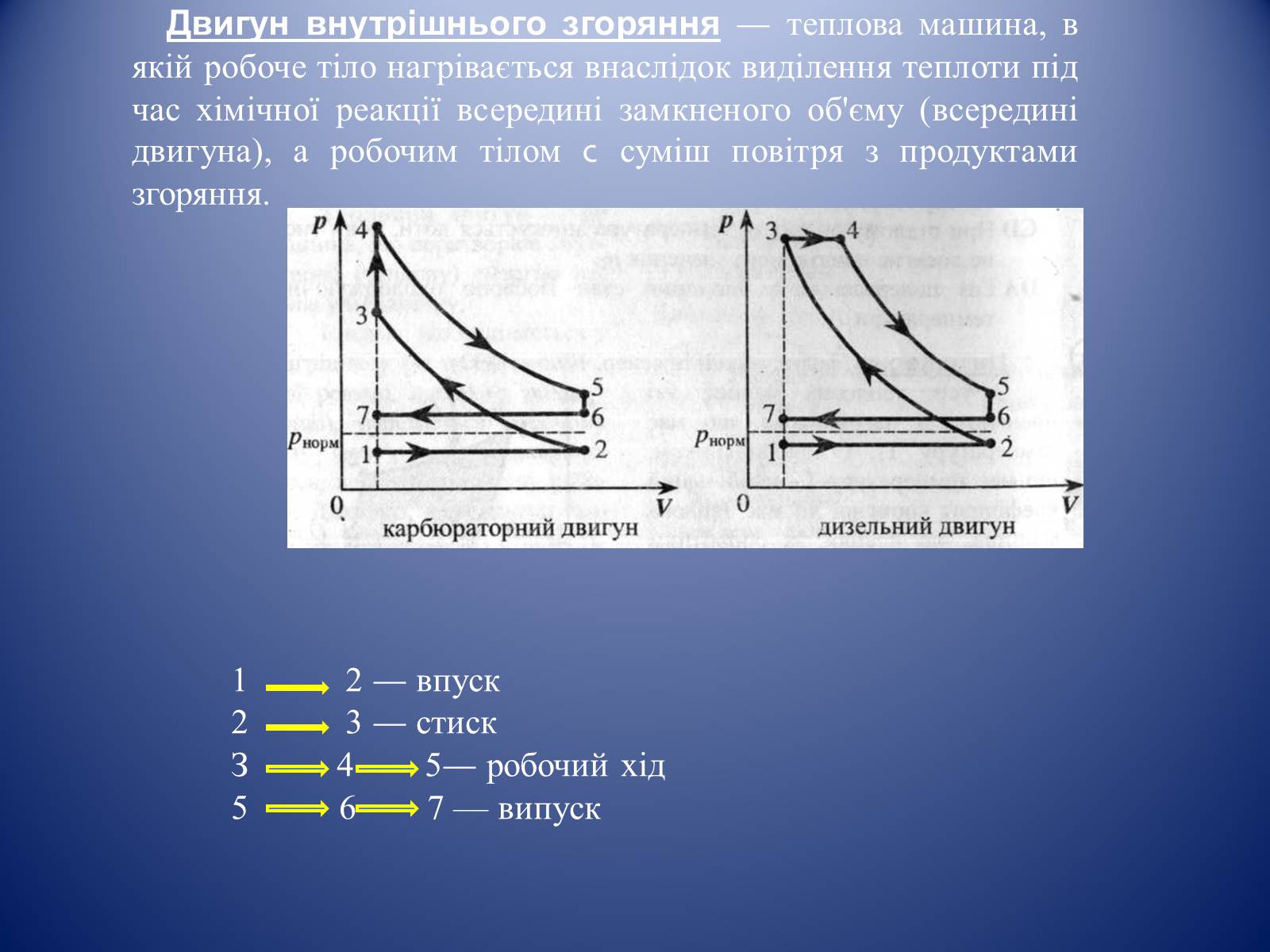
Двигун внутрішнього згоряння — теплова машина, в якій робоче тіло нагрівається внаслідок виділення теплоти під час хімічної реакції всередині замкненого об'єму (всередині двигуна), а робочим тілом с суміш повітря з продуктами згоряння.
1 2 — впуск
2 3 — стиск
З 4 5— робочий хід
6 7 — випуск
1 2 — впуск
2 3 — стиск
З 4 5— робочий хід
6 7 — випуск