- Головна
- Готові шкільні презентації
- Презентація на тему «Електролітична дисоціація. Електроліти і неелектроліти»
Презентація на тему «Електролітична дисоціація. Електроліти і неелектроліти»
306
Слайд #1
Тема: Електролітична дисоціація. Електроліти і неелектроліти.

Слайд #2
Чи всі речовини проводять струм?

Слайд #3
Мета уроку: дати відповідь на запитання: Чому одні речовини проводять струм, а інші - ні? Як їх класифікують? Що відбувається з речовинами, коли їх розчиняють?

Слайд #4
Майкл Фарадей
запропонував поділити речовини на дві групи за здатністю проводити струм.
запропонував поділити речовини на дві групи за здатністю проводити струм.

Слайд #5
Натисніть
Натисніть
Клас сполук
Клас сполук
Тип зв'язку
Тип зв'язку
Натисніть
Клас сполук
Клас сполук
Тип зв'язку
Тип зв'язку
Слайд #6
Чому електроліти проводять струм?
При розчиненні речовини чи при сплавленні з'являються зарядженні частинки, які можуть вільно рухатися. Ці частинки називаються йонами.
Електролітична дисоціація – процес розщеплення електролітів на йони під час розчинення або розплавлення. (с. 65 підручника)
При розчиненні речовини чи при сплавленні з'являються зарядженні частинки, які можуть вільно рухатися. Ці частинки називаються йонами.
Електролітична дисоціація – процес розщеплення електролітів на йони під час розчинення або розплавлення. (с. 65 підручника)

Слайд #7
Теорію електролітичної дисоціації сформулював швед Сванте Арреніус (1887 р.), за що у 1901 р. отримав Нобелівську премію з хімії.

Слайд #8
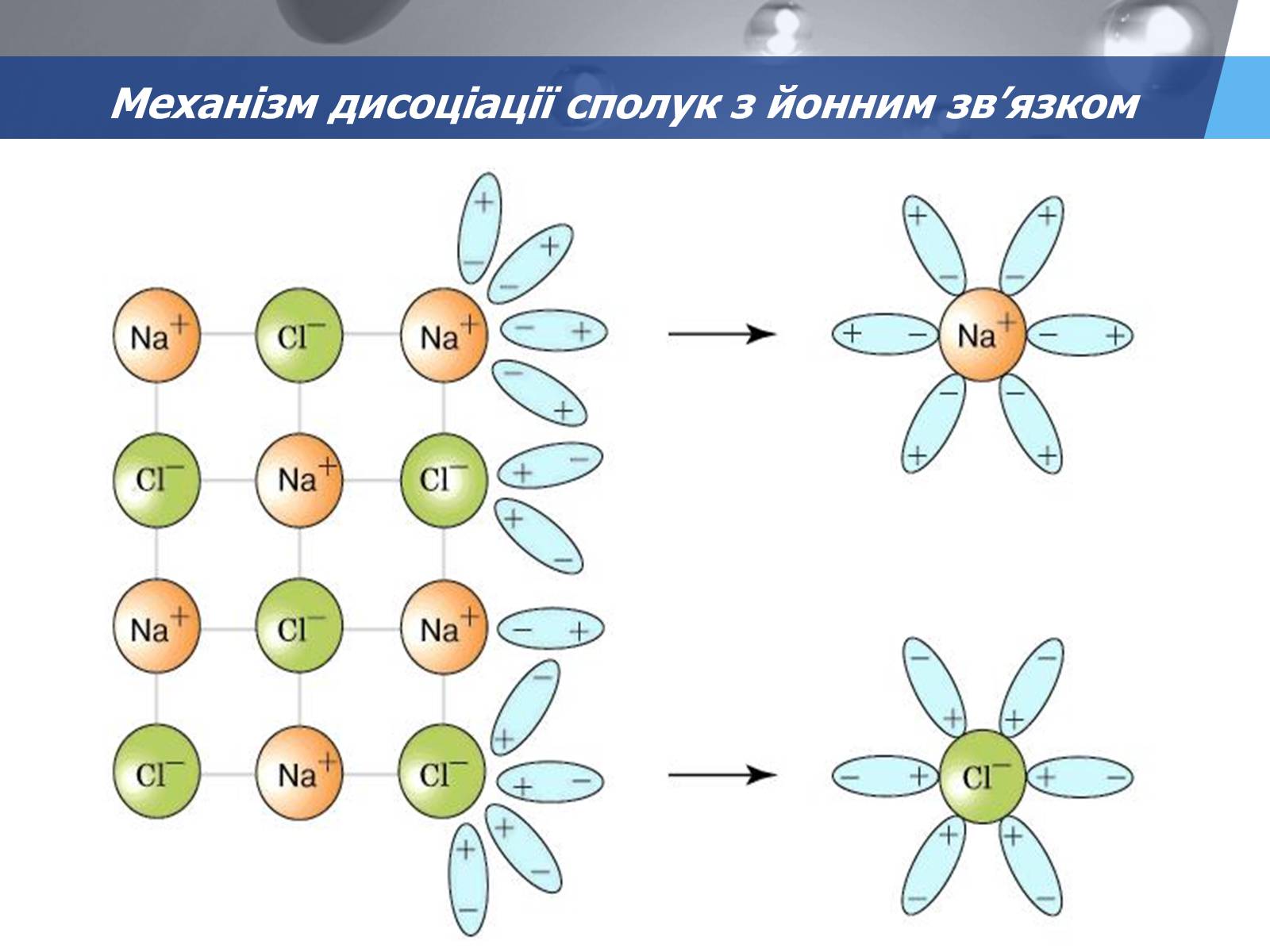
Механізм дисоціації сполук з йонним зв'язком
Слайд #9
Прослідовність процесів:
Орієнтація диполей води біля йонів кристалу.
Гідратація - взаємодія молекул води з йонами
Дисоціація (розпад) кристала на гідратовані йони.
Рівняння: NaCl ↔ Na+ + Cl-
Механізм дисоціації сполук з йонним зв'язком
Орієнтація диполей води біля йонів кристалу.
Гідратація - взаємодія молекул води з йонами
Дисоціація (розпад) кристала на гідратовані йони.
Рівняння: NaCl ↔ Na+ + Cl-
Механізм дисоціації сполук з йонним зв'язком

Слайд #10
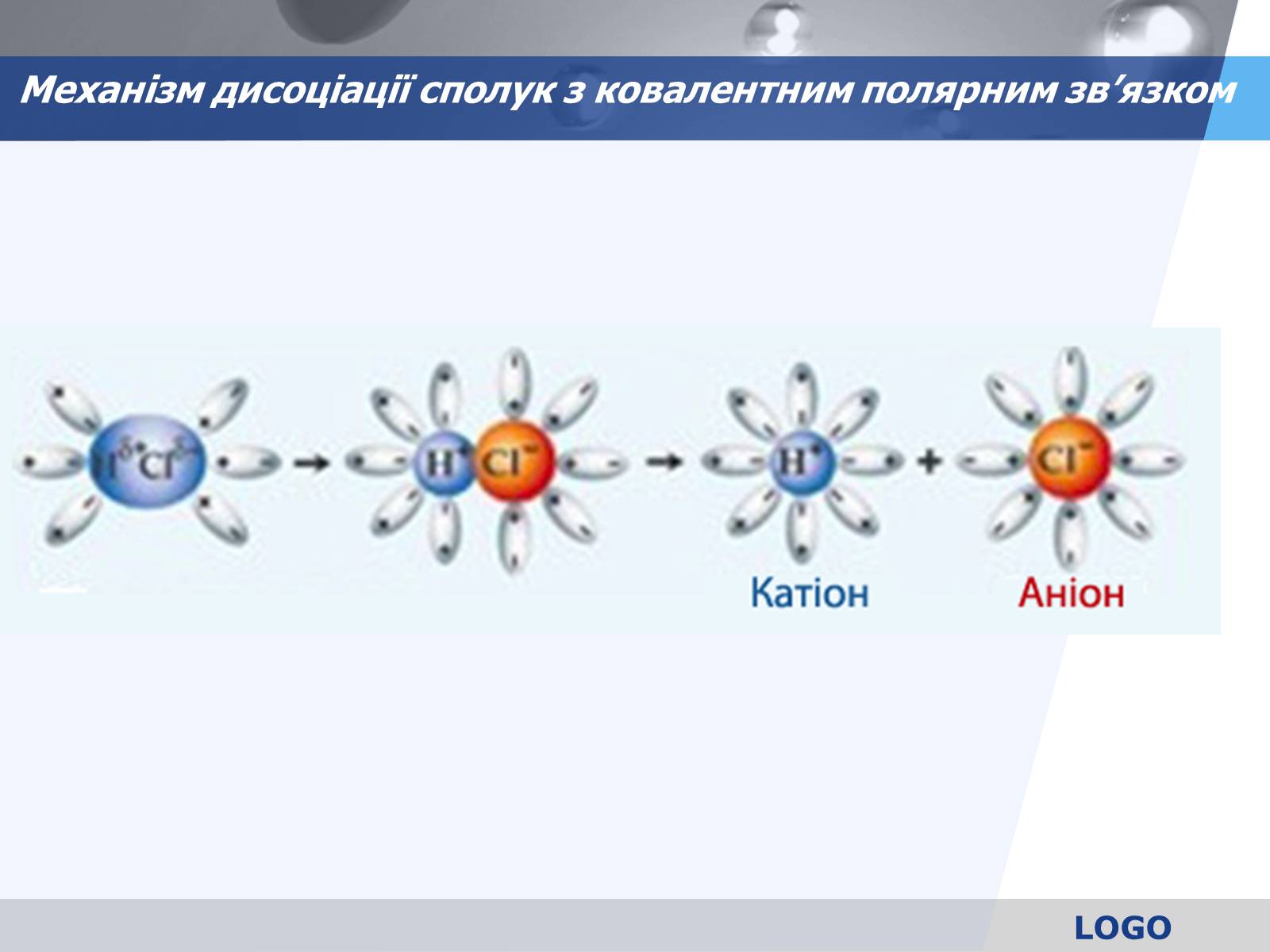
Механізм дисоціації сполук з ковалентним полярним зв'язком
Слайд #11
Механізм дисоціації сполук з ковалентним полярним зв'язком
Прослідовність процесів:
Орієнтація диполей води навколо полюсів молекули НСl
Гідратація - взаємодія молекул води з НСl
Йонізація молекули електроліта (перетворення ковалентного зв'язку на йонний)
Дисоціація (розпад) молекули електроліту на гідратовані йони.
Рівняння: НCl ↔ Н+ + Cl-
Прослідовність процесів:
Орієнтація диполей води навколо полюсів молекули НСl
Гідратація - взаємодія молекул води з НСl
Йонізація молекули електроліта (перетворення ковалентного зв'язку на йонний)
Дисоціація (розпад) молекули електроліту на гідратовані йони.
Рівняння: НCl ↔ Н+ + Cl-

Слайд #12
Узагальнення й систематизація знань

Слайд #13
На які групи можна поділити речовини за їх здатністю проводити електричний струм?
Який вчений запропонував поділ речовин на ці дві групи?
Який вчений запропонував поділ речовин на ці дві групи?

Слайд #14
Електроліти
Неелектроліти
Визначення понять
Речовини, що належать до даної групи
Тип зв'язку
Заповніть таблицю
Неелектроліти
Визначення понять
Речовини, що належать до даної групи
Тип зв'язку
Заповніть таблицю

Слайд #15
Підкресліть речовини – електроліти
хлоридна кислота, кисень, натрій хлорид,
натрій гідроксид, спирт, ацетон, кальцій гідроксид, глюкоза, вуглекислий газ, сульфатна кислота.
хлоридна кислота, кисень, натрій хлорид,
натрій гідроксид, спирт, ацетон, кальцій гідроксид, глюкоза, вуглекислий газ, сульфатна кислота.

Слайд #16
Які із зображених речовин будуть проводити електричний струм?
Розчини солей
Інертні гази та кисень
Розчин натрій гідроксиду
Розчини солей
Інертні гази та кисень
Розчин натрій гідроксиду

Слайд #17
Домашнє завдання:
§ 10, № 6 с. 65
§ 10, № 6 с. 65
