- Головна
- Готові шкільні презентації
- Презентація на тему «Молекулярна фізика»
Презентація на тему «Молекулярна фізика»
229
Слайд #1
МОЛЕКУЛЯРНА ФІЗИКА.
ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ (MKT)
ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ (MKT)

Слайд #2
Питання для опрацювання матеріалу
Основні положення MKT та їх дослідне підтвердження.
Що таке атом (молекула)?
Що називається молярною масою?
Що таке кількість речовини (одиниці виміру)?
Дати визначення поняття концентрації; назвати числове значення сталої Авогадро.
Що називається дифузією; броунівським рухом?
Агрегатні стани речовини та їх пояснення з точки зору MKT (основні властивості).
Швидкість молекул, дослід Штерна.
Основне рівняння MKT; фізичний смисл рівняння.
Температура, теплова рівновага; абсолютний нуль.
Ідеальний газ; параметри, що характеризують ідеальний газ.
Стала Больцмана; універсальна газова стала.
Рівняння стану ідеального газу (Менделєєва-Клапейрона).
Газові закони (ізопроцеси в газах); графіки, що характеризують закони.
Прилади, що вимірюють параметри газів.
Основні положення MKT та їх дослідне підтвердження.
Що таке атом (молекула)?
Що називається молярною масою?
Що таке кількість речовини (одиниці виміру)?
Дати визначення поняття концентрації; назвати числове значення сталої Авогадро.
Що називається дифузією; броунівським рухом?
Агрегатні стани речовини та їх пояснення з точки зору MKT (основні властивості).
Швидкість молекул, дослід Штерна.
Основне рівняння MKT; фізичний смисл рівняння.
Температура, теплова рівновага; абсолютний нуль.
Ідеальний газ; параметри, що характеризують ідеальний газ.
Стала Больцмана; універсальна газова стала.
Рівняння стану ідеального газу (Менделєєва-Клапейрона).
Газові закони (ізопроцеси в газах); графіки, що характеризують закони.
Прилади, що вимірюють параметри газів.

Слайд #3
ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ (MKT)
Молекулярна фізика — розділ фізики, в якому вивчають фізичні властивості тіл у різних агрегатних станах на основі розгляду їх мікроскопічної (молекулярної) будови.
Для опису використовують два основні методи: молекулярно-кінетичний (статистичний) і термодинамічний.
Молекулярно-кінетичний метод ґрунтується на основі уявлень про частинки речовини, їх рух і взаємодію. Вчення називається MKT.
Молекулярна фізика — розділ фізики, в якому вивчають фізичні властивості тіл у різних агрегатних станах на основі розгляду їх мікроскопічної (молекулярної) будови.
Для опису використовують два основні методи: молекулярно-кінетичний (статистичний) і термодинамічний.
Молекулярно-кінетичний метод ґрунтується на основі уявлень про частинки речовини, їх рух і взаємодію. Вчення називається MKT.

Слайд #4
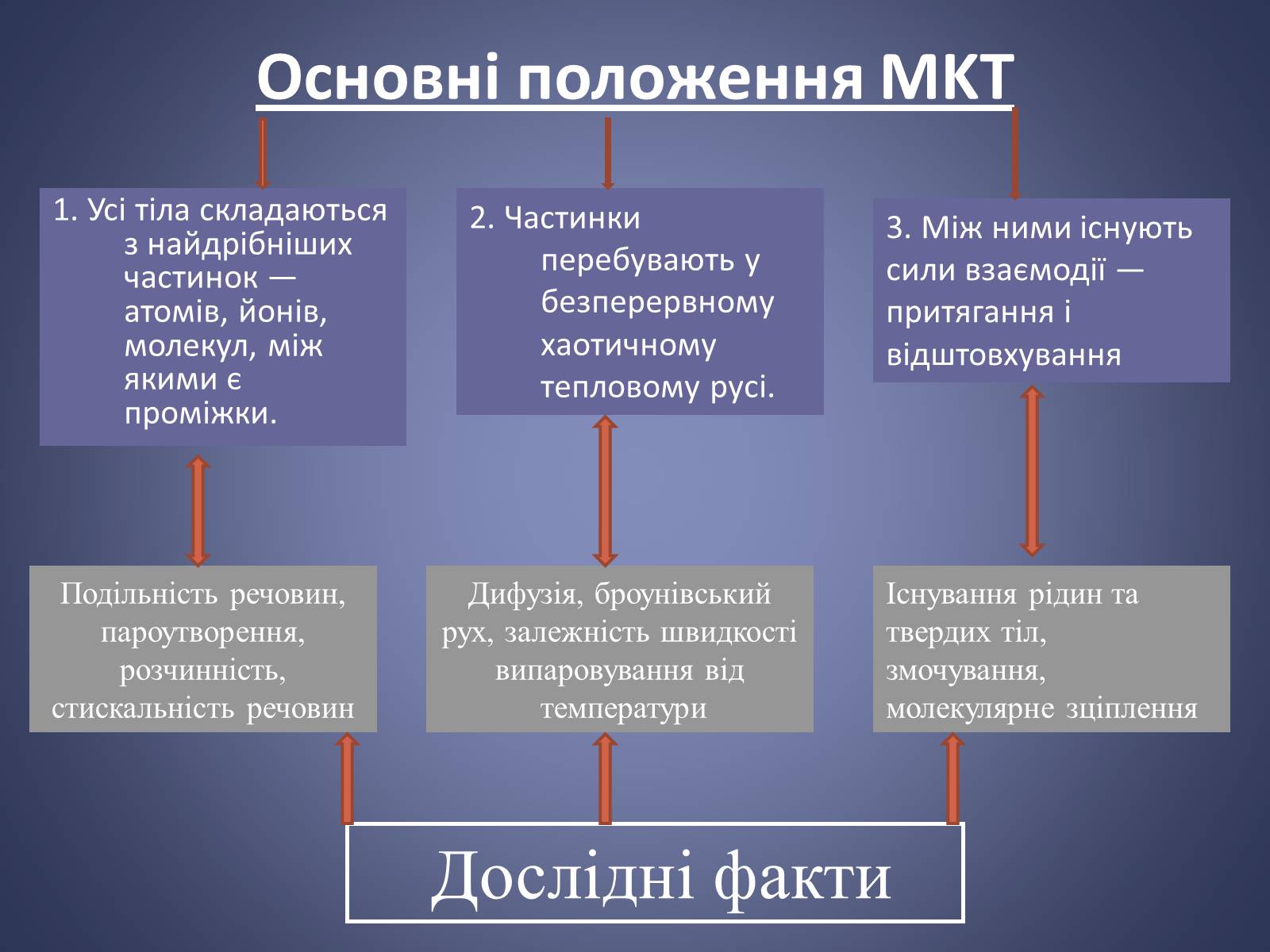
Основні положення MKT
1. Усі тіла складаються з найдрібніших частинок — атомів, йонів, молекул, між якими є проміжки.
2. Частинки перебувають у безперервному хаотичному тепловому русі.
3. Між ними існують сили взаємодії — притягання і відштовхування
Подільність речовин, пароутворення, розчинність, стискальність речовин
Дифузія, броунівський рух, залежність швидкості випаровування від
температури
Існування рідин та твердих тіл, змочування, молекулярне зціплення
Дослідні факти
1. Усі тіла складаються з найдрібніших частинок — атомів, йонів, молекул, між якими є проміжки.
2. Частинки перебувають у безперервному хаотичному тепловому русі.
3. Між ними існують сили взаємодії — притягання і відштовхування
Подільність речовин, пароутворення, розчинність, стискальність речовин
Дифузія, броунівський рух, залежність швидкості випаровування від
температури
Існування рідин та твердих тіл, змочування, молекулярне зціплення
Дослідні факти
Слайд #5
Дослідні обгрунтування положень MKT
1. а) молекули і атоми можна бачити в електронний та тунельний
мікроскопи;
б)tнаявність межі подрібнення речовини послідовним розведеннямрозчинів, при якій неможливо встановити наявність розчиненоїречовини;
в)tутворення мономолекулярних плівок;
г)tзмішування рідин, газів (1 л води + 1 л спирту < 2 л розчину);
2. а) Дифузія — явище проникнення молекул однієї речовини в міжмолекулярні проміжки іншої (підтверджує хаотичний рух молекул);
б)tброунівський рух — хаотичний рух макроскопічних частинок,завислих у рідині чи газі, зумовлений ударами з боку молекул («танець» пилинок в сонячному світлі);
в)tосмос — проникнення речовин через пористі перегородки (коренірослин, легені (100 м2 ), кишечник (5 м2)).
3. а) збереження форми та об'єму твердим тілом, об'єму — рідиною;
б)tвиготовлення деталей методом порошкової металургії;
в)tдля стискання чи пресування потрібна велика сила.
1. а) молекули і атоми можна бачити в електронний та тунельний
мікроскопи;
б)tнаявність межі подрібнення речовини послідовним розведеннямрозчинів, при якій неможливо встановити наявність розчиненоїречовини;
в)tутворення мономолекулярних плівок;
г)tзмішування рідин, газів (1 л води + 1 л спирту < 2 л розчину);
2. а) Дифузія — явище проникнення молекул однієї речовини в міжмолекулярні проміжки іншої (підтверджує хаотичний рух молекул);
б)tброунівський рух — хаотичний рух макроскопічних частинок,завислих у рідині чи газі, зумовлений ударами з боку молекул («танець» пилинок в сонячному світлі);
в)tосмос — проникнення речовин через пористі перегородки (коренірослин, легені (100 м2 ), кишечник (5 м2)).
3. а) збереження форми та об'єму твердим тілом, об'єму — рідиною;
б)tвиготовлення деталей методом порошкової металургії;
в)tдля стискання чи пресування потрібна велика сила.

Слайд #6
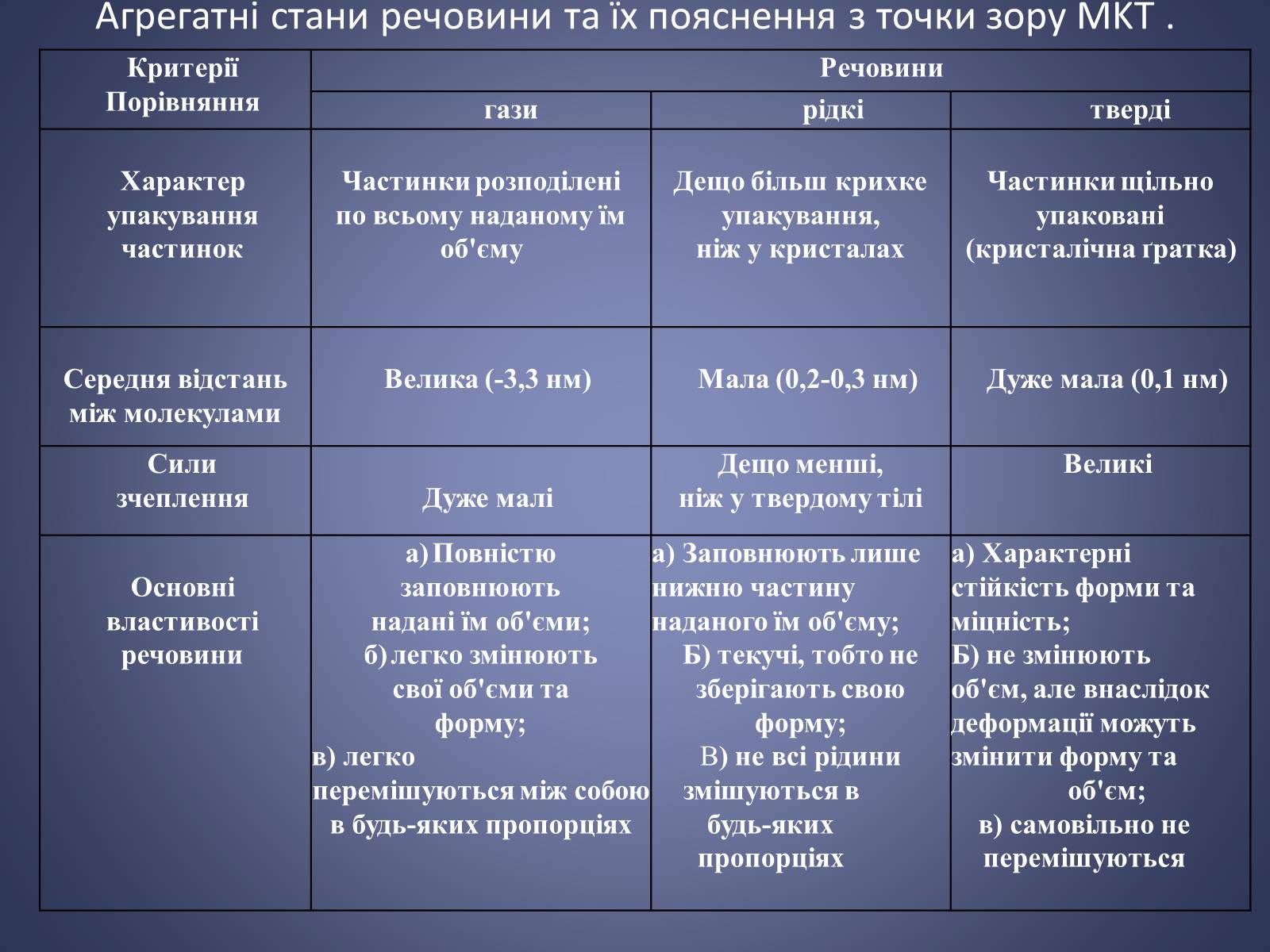
Агрегатні стани речовини та їх пояснення з точки зору MKT .
Критерії
Порівняння
Речовини
гази
рідкі
тверді
Характер
упакування
частинок
Частинки розподілені
по всьому наданому їм об'єму
Дещо більш крихке упакування,
ніж у кристалах
Частинки щільно
упаковані
(кристалічна ґратка)
Середня відстань
між молекулами
Велика (-3,3 нм)
Мала (0,2-0,3 нм)
Дуже мала (0,1 нм)
Сили
зчеплення
Дуже малі
Дещо менші,
ніж у твердому тілі
Великі
Основні
властивості
речовини
а)tПовністюзаповнюютьнадані їм об'єми;
б)tлегко змінюютьсвої об'єми таформу;
в) легко
перемішуються між собою в будь-яких пропорціях
а) Заповнюють лишенижню частинунаданого їм об'єму;
Б) текучі, тобто незберігають своюформу;
В) не всі рідини
змішуються в будь-яких пропорціях
а) Характерністійкість форми таміцність;
Б) не змінюютьоб'єм, але внаслідокдеформації можутьзмінити форму та
об'єм;
в) самовільно не перемішуються
Критерії
Порівняння
Речовини
гази
рідкі
тверді
Характер
упакування
частинок
Частинки розподілені
по всьому наданому їм об'єму
Дещо більш крихке упакування,
ніж у кристалах
Частинки щільно
упаковані
(кристалічна ґратка)
Середня відстань
між молекулами
Велика (-3,3 нм)
Мала (0,2-0,3 нм)
Дуже мала (0,1 нм)
Сили
зчеплення
Дуже малі
Дещо менші,
ніж у твердому тілі
Великі
Основні
властивості
речовини
а)tПовністюзаповнюютьнадані їм об'єми;
б)tлегко змінюютьсвої об'єми таформу;
в) легко
перемішуються між собою в будь-яких пропорціях
а) Заповнюють лишенижню частинунаданого їм об'єму;
Б) текучі, тобто незберігають своюформу;
В) не всі рідини
змішуються в будь-яких пропорціях
а) Характерністійкість форми таміцність;
Б) не змінюютьоб'єм, але внаслідокдеформації можутьзмінити форму та
об'єм;
в) самовільно не перемішуються
Слайд #7
Сили взаємодії між молекулами
Сили притягання і відштовхування діють одночасно.
При зменшенні відстані до r0 швидше зростає сила притягання; далі (r < r0) переважає сила відштовхування.
При r = r0 — положення стійкої рівноваги.
Сили притягання і відштовхування діють одночасно.
При зменшенні відстані до r0 швидше зростає сила притягання; далі (r < r0) переважає сила відштовхування.
При r = r0 — положення стійкої рівноваги.

Слайд #8
Основні поняття MKT
Атом — це найменша частина хімічного елемента, яка є носієм його властивостей та не ділиться в процесі хімічних реакцій
Молекула — це найменша стійка частинка речовини, яка має її основні хімічні властивості та складається з атомів одного (проста речовина) або кількох (складна речовина) хімічних елементів Примітка. Атоми можна розглядати як одноатомні молекули
Атом — це найменша частина хімічного елемента, яка є носієм його властивостей та не ділиться в процесі хімічних реакцій
Молекула — це найменша стійка частинка речовини, яка має її основні хімічні властивості та складається з атомів одного (проста речовина) або кількох (складна речовина) хімічних елементів Примітка. Атоми можна розглядати як одноатомні молекули

Слайд #9
3. Маси молекул і атомів (виражені в одиницях СІ) дуже маленькі, а тому
незручні для користування. їх порівнюють з
1/12 тос = 1а.о.м. = 1,66∙10-27кг.
Відносною молекулярною (або атомною масою) речовини називають відношення маси молекули (або атома) т0 даної речовини до 1/12маси атома вуглецю тос.
незручні для користування. їх порівнюють з
1/12 тос = 1а.о.м. = 1,66∙10-27кг.
Відносною молекулярною (або атомною масою) речовини називають відношення маси молекули (або атома) т0 даної речовини до 1/12маси атома вуглецю тос.

Слайд #10
4. Розмір молекул дуже малий, тому їх кількість у макроскопічому тілі велика, що незручно. Тому використовують відносну кількість молекул, порівнюючи з 1 молем.
Моль — це кількість речовини, в якій міститься стільки молекул чи атомів, скільки є атомів в 0,012 кг вуглецю.
Незалежно від агрегатного стану, моль речовини містить одне і те ж число молекул N А = 6,02 • 1023 моль -1 (стала Авогадро).
5. Кількість речовини ν — це кількість молей, тобто відношення числа молекул (чи атомів) N у даному тілі до числа молекул (чи атомів) NА в 1 молі.
Моль — це кількість речовини, в якій міститься стільки молекул чи атомів, скільки є атомів в 0,012 кг вуглецю.
Незалежно від агрегатного стану, моль речовини містить одне і те ж число молекул N А = 6,02 • 1023 моль -1 (стала Авогадро).
5. Кількість речовини ν — це кількість молей, тобто відношення числа молекул (чи атомів) N у даному тілі до числа молекул (чи атомів) NА в 1 молі.

Слайд #11
6. Молярна маса — фізична величина, що дорівнює відношенню маси речовини т до кількості речовини V.
. Іншими словами, це маса речовини, взятої в кількості одного моля.
Оскільки в 1 молі є NА молекул, то
М = т0NА , M = Mr ∙10-3 кг/моль
Авогадро встановив, що моль газу за нормальних умов займає об'єм
. Іншими словами, це маса речовини, взятої в кількості одного моля.
Оскільки в 1 молі є NА молекул, то
М = т0NА , M = Mr ∙10-3 кг/моль
Авогадро встановив, що моль газу за нормальних умов займає об'єм

Слайд #12
Молярний об'єм – це об'єм одного моля речовини:

Слайд #13
Концентрація молекул (n) — число молекул в одиниці об'єму.
[n]=м⁻³
[n]=м⁻³
