- Головна
- Готові шкільні презентації
- Презентація на тему «Електричний струм у розчинах і розплавах електролітів» (варіант 2)
Презентація на тему «Електричний струм у розчинах і розплавах електролітів» (варіант 2)
483
Слайд #1
Явища електролітичної дисоціації і електролізу
Електричний струм у розчинах і розплавах електролітів
Електричний струм у розчинах і розплавах електролітів

Слайд #2
Електролітична дисоціація
Із курсу хімії нам вже відоме таке явище як електролітична дисоціація. Це розпад електролітів (речовин, розплавів або розчинів, які проводять струм) на йони при розчиненні у полярному розчиннику.
Із курсу хімії нам вже відоме таке явище як електролітична дисоціація. Це розпад електролітів (речовин, розплавів або розчинів, які проводять струм) на йони при розчиненні у полярному розчиннику.

Слайд #3
Внаслідок взаємодії молекул розчинюваної речовини і розчинника послаблюється взаємодія між йонами розчинюваної речовини і молекула може розпастися на йони.

Слайд #4
В електроліті з'являються вільні носії зарядів і він починає проводити струм. Оскільки заряд у водних розчинах чи розплавах електролітів переноситься йонами, то таку провідність називають йонною. За йонної провідності проходження струму пов'язано із перенесенням речовини. Процес, що відбувається далі називається електролізом.

Слайд #5
Електроліз
На електродах відбувається виділення речовин, які входять до складу електроліту. Цей процес і називають електролізом. На аноді негативно заряджені частинки віддають свої зайві електрони (окиснювальна реакція), а на катоді позитивні йони отримують електрони (реакція відновлення). У розчині може відбуватися процес об'єднання йонів у нейтральні молекули, такий процес називається рекомбінацією.
На електродах відбувається виділення речовин, які входять до складу електроліту. Цей процес і називають електролізом. На аноді негативно заряджені частинки віддають свої зайві електрони (окиснювальна реакція), а на катоді позитивні йони отримують електрони (реакція відновлення). У розчині може відбуватися процес об'єднання йонів у нейтральні молекули, такий процес називається рекомбінацією.

Слайд #6
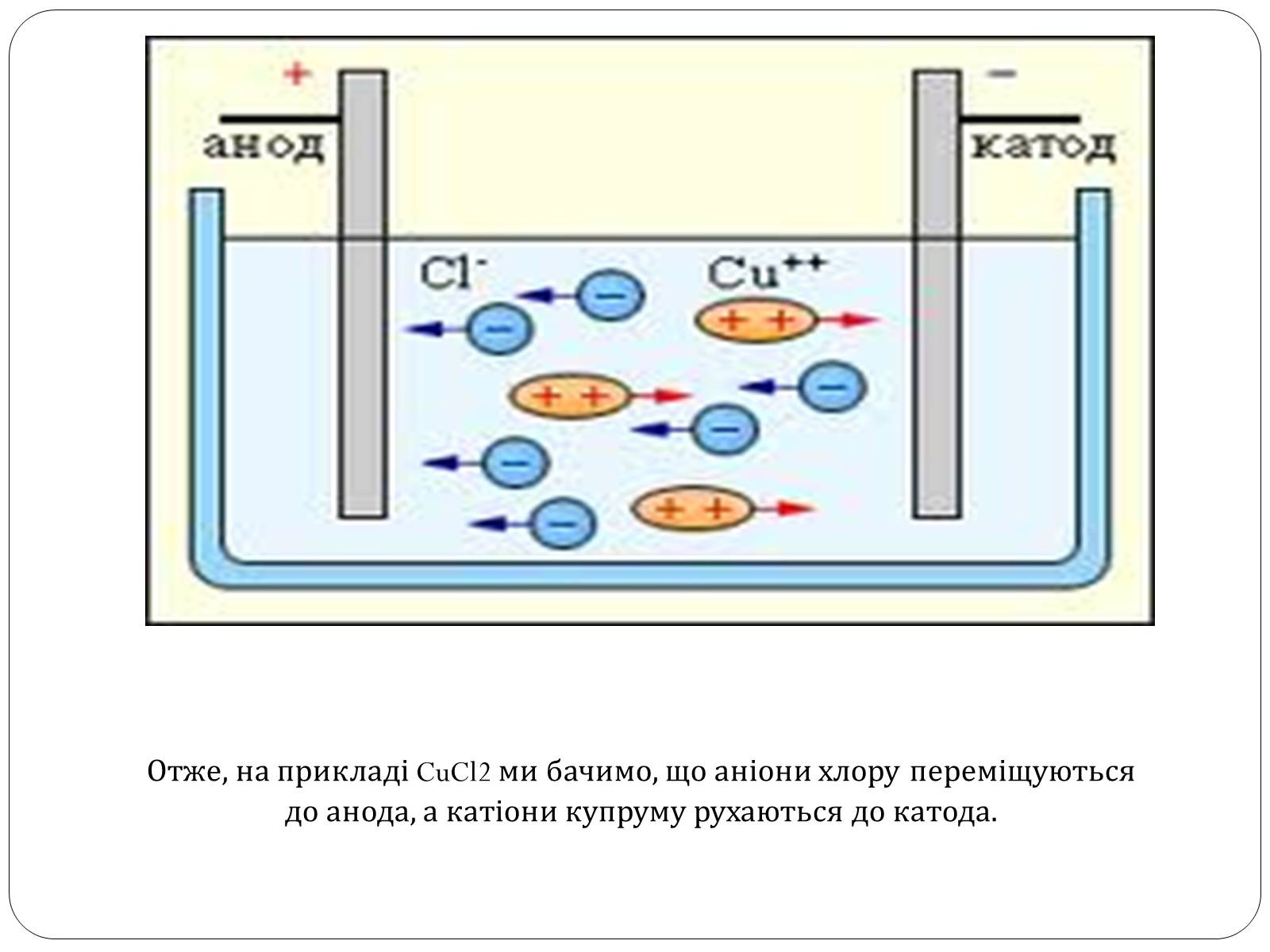
Елекроліз водного розчину хлориду
Отже, на прикладі CuCl2 ми бачимо, що аніони хлору переміщуються до анода, а катіони купруму рухаються до катода.
Отже, на прикладі CuCl2 ми бачимо, що аніони хлору переміщуються до анода, а катіони купруму рухаються до катода.
Слайд #7
Після досліджень електролізу У.Нікольсона і А.Карлейла у 1833 році Майклом Фарадеєм був установлен закон, який дістав назву перший закон електролізу або закон Фарадея.Він звучить так: маса речовини m, що виділяється на аноді або катоді під час проходження електричного струму в електролітах, прямо пропорційна заряду q, який при цьому переноситься йонами через електроліт: m=kq.
Майкл Фарадей
Майкл Фарадей

Слайд #8
m-маса(Кг);q-заряд(Кл);k- електрохімічний еквівалент
Електрохімічний еквівалент показує, яка маса даної речовини в кілограмах виділяється на електроді при перенесенні заряду в один кулон.
Враховуючи те, що при постійному струмі q=I△t, то закон Фарадея можна записати у вигляді m=kI△t.
m
k
q
Електрохімічний еквівалент показує, яка маса даної речовини в кілограмах виділяється на електроді при перенесенні заряду в один кулон.
Враховуючи те, що при постійному струмі q=I△t, то закон Фарадея можна записати у вигляді m=kI△t.
m
k
q

Слайд #9
Другий закон електролізу
Другий закон Фарадея визначає величину електрохімічного еквівалента k.
Електрохімічний еквівалент речовини прямо пропорційний молярній масі речовини M і обернено пропорційний її валентності n:
Величина F називаеться числом (сталою) Фарадея:
F=96 500 Кл/моль
Другий закон Фарадея визначає величину електрохімічного еквівалента k.
Електрохімічний еквівалент речовини прямо пропорційний молярній масі речовини M і обернено пропорційний її валентності n:
Величина F називаеться числом (сталою) Фарадея:
F=96 500 Кл/моль

Слайд #10
Явище електролізу має широке застосування в електрометалургії (добування чистих металів); рафінуванні (очищенні) металів; у гальваностегії (нанесення металевих покриттів для запобігання корозії металів); у гальванопластиці (виготовлення копій з матриць) тощо. Будову хімічних джерел струму (гальванічних елементів та акумуляторів) також засновано на процесах взаємодії металів з електролітами.

Слайд #11
Дякуємо вам за перегляд презентації на тему: «Електричний струм у розчинах і розплавах електролітів».
