- Головна
- Готові шкільні презентації
- Презентація на тему «Основи МКТ»
Презентація на тему «Основи МКТ»
258
Слайд #1
Основи МКТ
Газові закони
Газові закони

Слайд #2
Чому на балонах з газом пишуть: “Не нагрівати!”?
Чому нагріта медична банка “присмоктується” до тіла людини?
Чому від палаючих полін з тріском відлітають іскри?
Чому нагріта медична банка “присмоктується” до тіла людини?
Чому від палаючих полін з тріском відлітають іскри?

Слайд #3
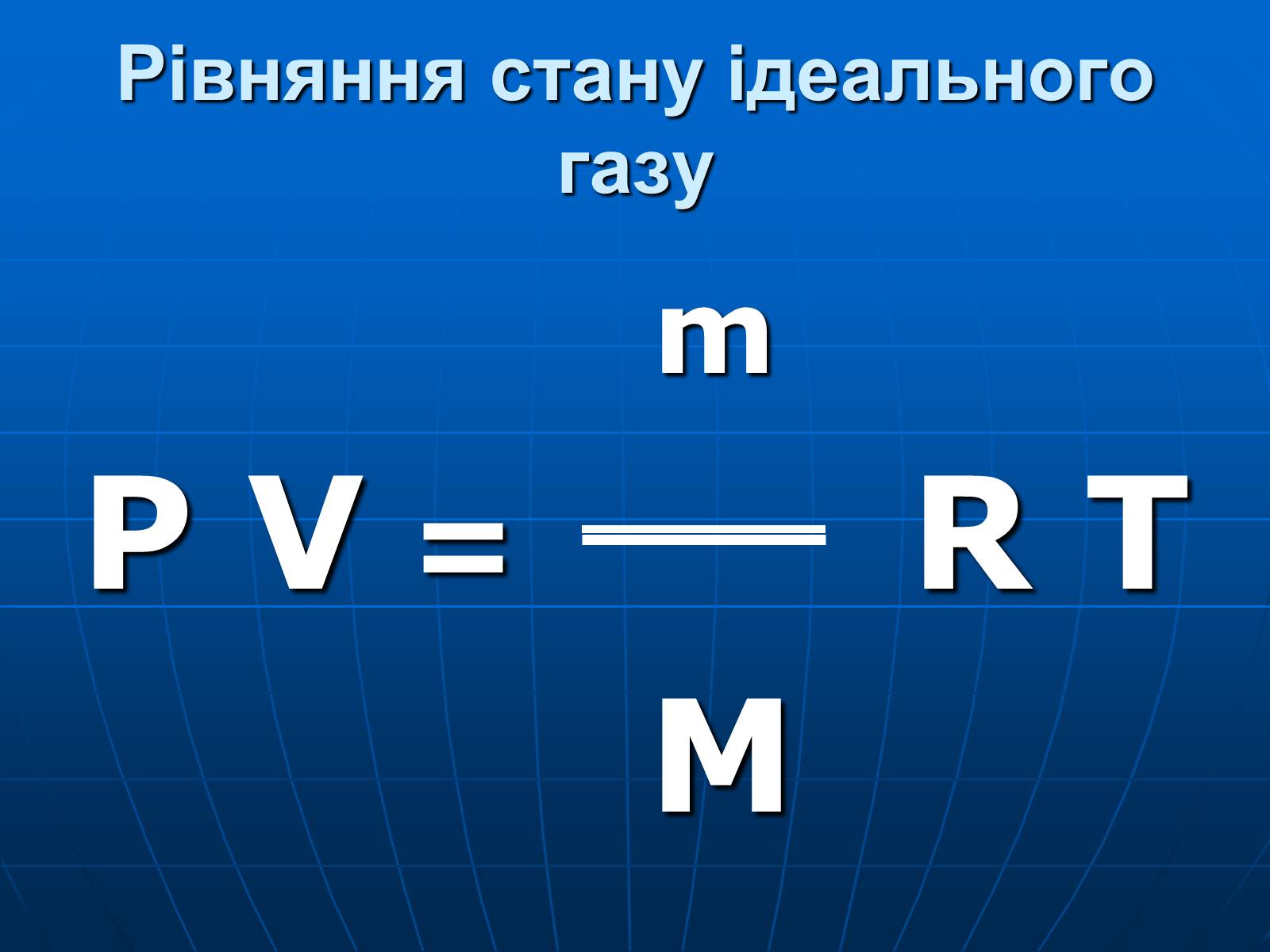
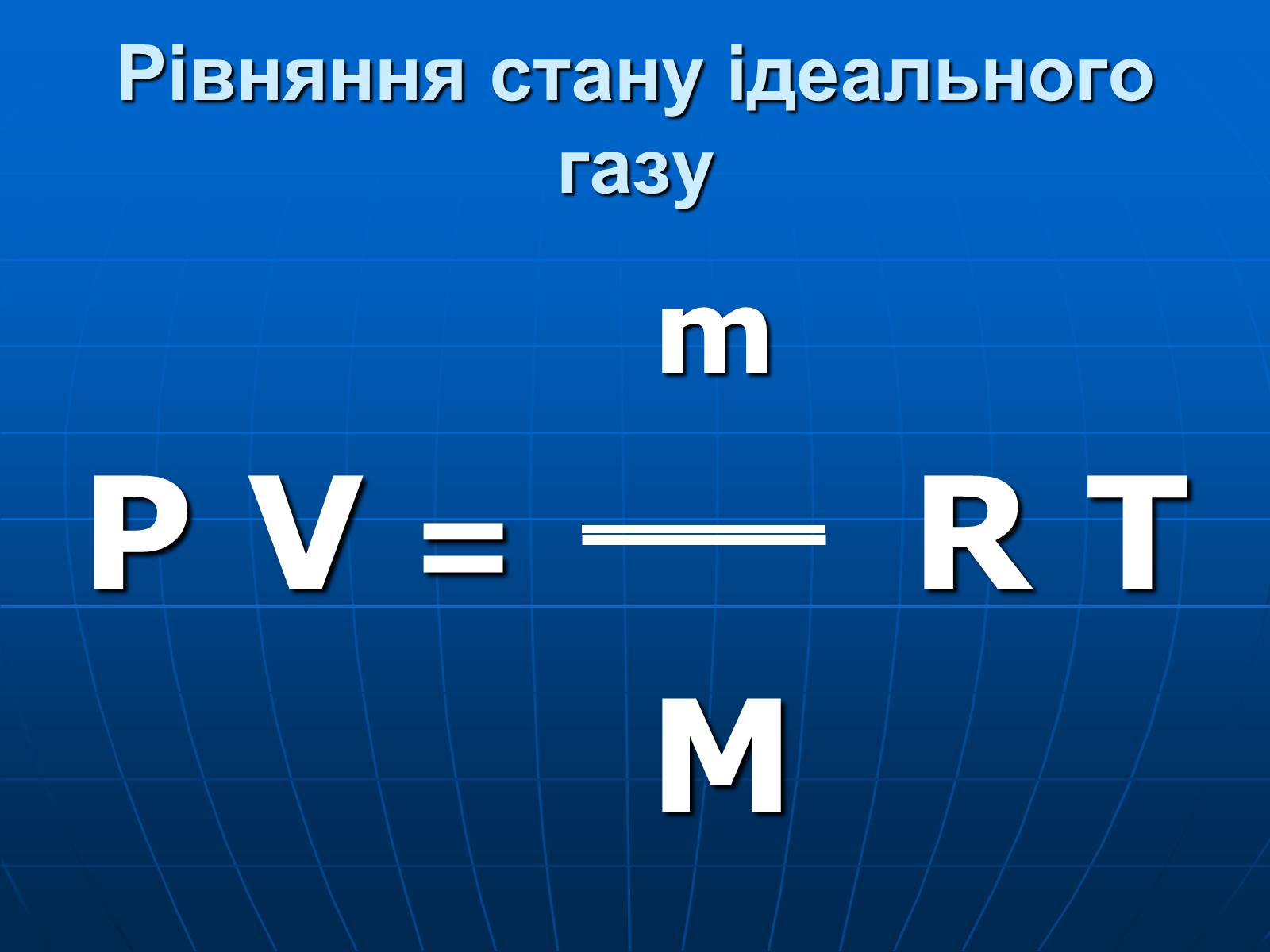
Рівняння стану ідеального газу
m
P V = R T
M
m
P V = R T
M
Слайд #4
Ізотермічний процес
m = const
M = const
T = const
Закон Бойля – Маріотта
PV = const !!!
m = const
M = const
T = const
Закон Бойля – Маріотта
PV = const !!!

Слайд #5
Запам‘ятай! Це закон!
Закон Бойля – Маріотта: для даної маси газу при незмінному хімічному складі, за незмінної температури, добуток тиску газу на його об'єм є величина стала ( тиск газу обернено пропорційний його об'єму ).
Закон Бойля – Маріотта: для даної маси газу при незмінному хімічному складі, за незмінної температури, добуток тиску газу на його об'єм є величина стала ( тиск газу обернено пропорційний його об'єму ).

Слайд #6
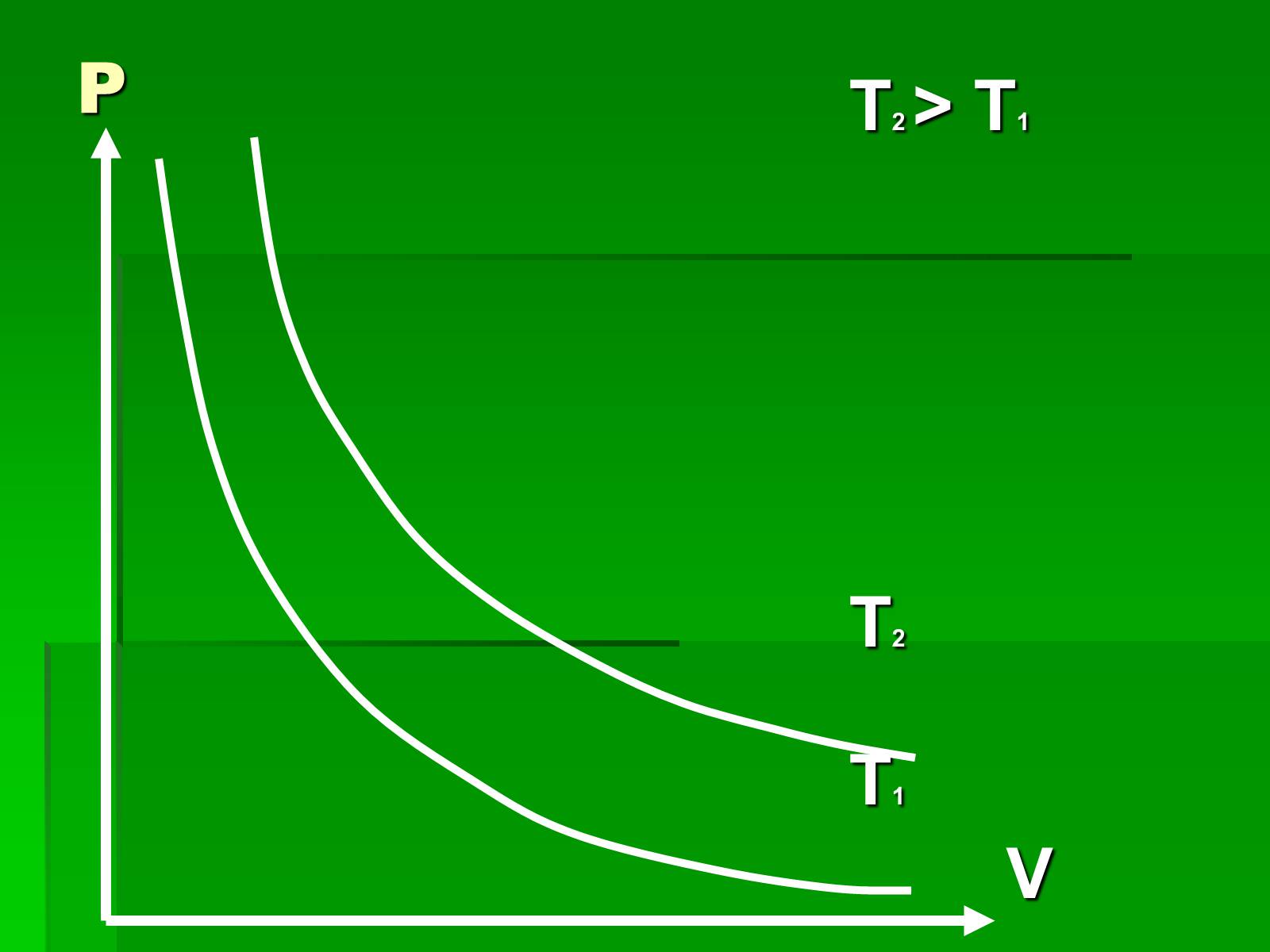
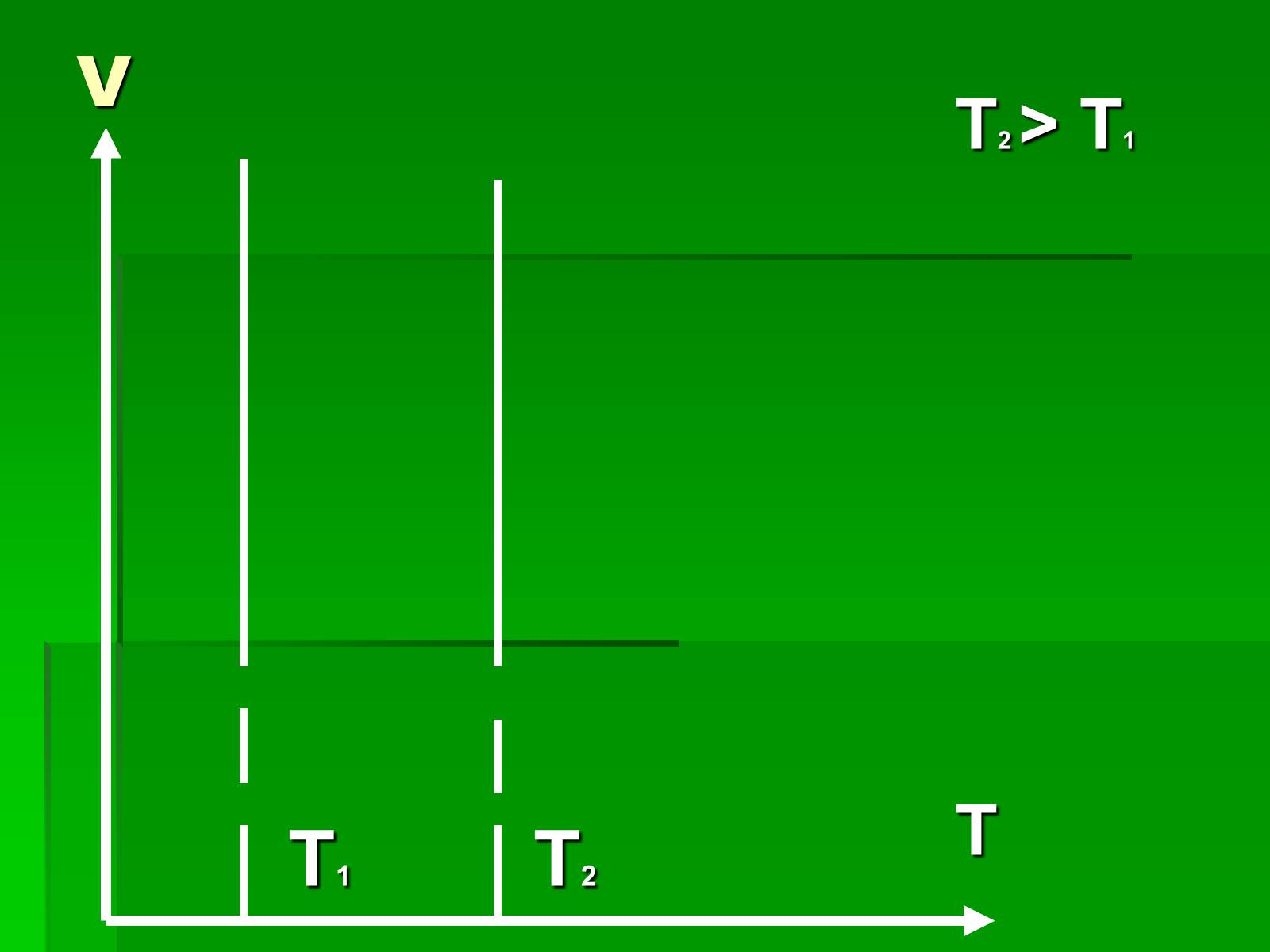
Графіки ізотермічного процесу

Слайд #7
P
T2 > T1
T2
T1
V
T2 > T1
T2
T1
V
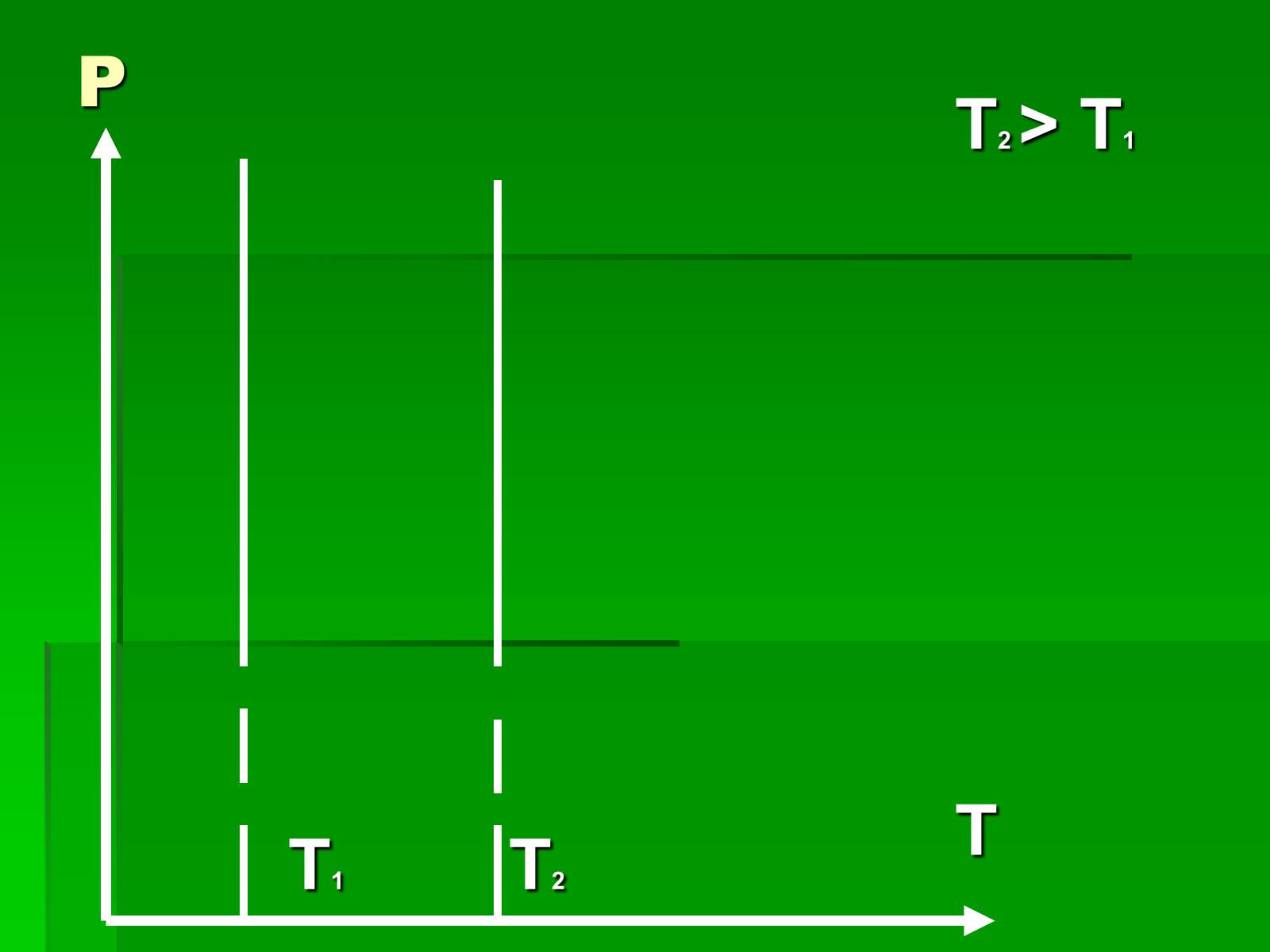
Слайд #8
T1 T2
P
T2 > T1
T
P
T2 > T1
T
Слайд #9
T1 T2
V
T2 > T1
T
V
T2 > T1
T
Слайд #10
Рівняння стану ідеального газу
m
P V = R T
M
m
P V = R T
M
Слайд #11
Ізобарний процес
m = const
M = const
P = const
Закон Гей - Люссака
V
--- = const !!!
T
m = const
M = const
P = const
Закон Гей - Люссака
V
--- = const !!!
T

Слайд #12
Запам‘ятай! Це закон!
Закон Гей – Люссака: для даної маси газу та незмінного хімічного складу, при сталому тиску, відношення об'єму газу до його абсолютної температури є величина стала
( об'єм газу прямо пропорційний його абсолютній температурі ).
Закон Гей – Люссака: для даної маси газу та незмінного хімічного складу, при сталому тиску, відношення об'єму газу до його абсолютної температури є величина стала
( об'єм газу прямо пропорційний його абсолютній температурі ).

Слайд #13
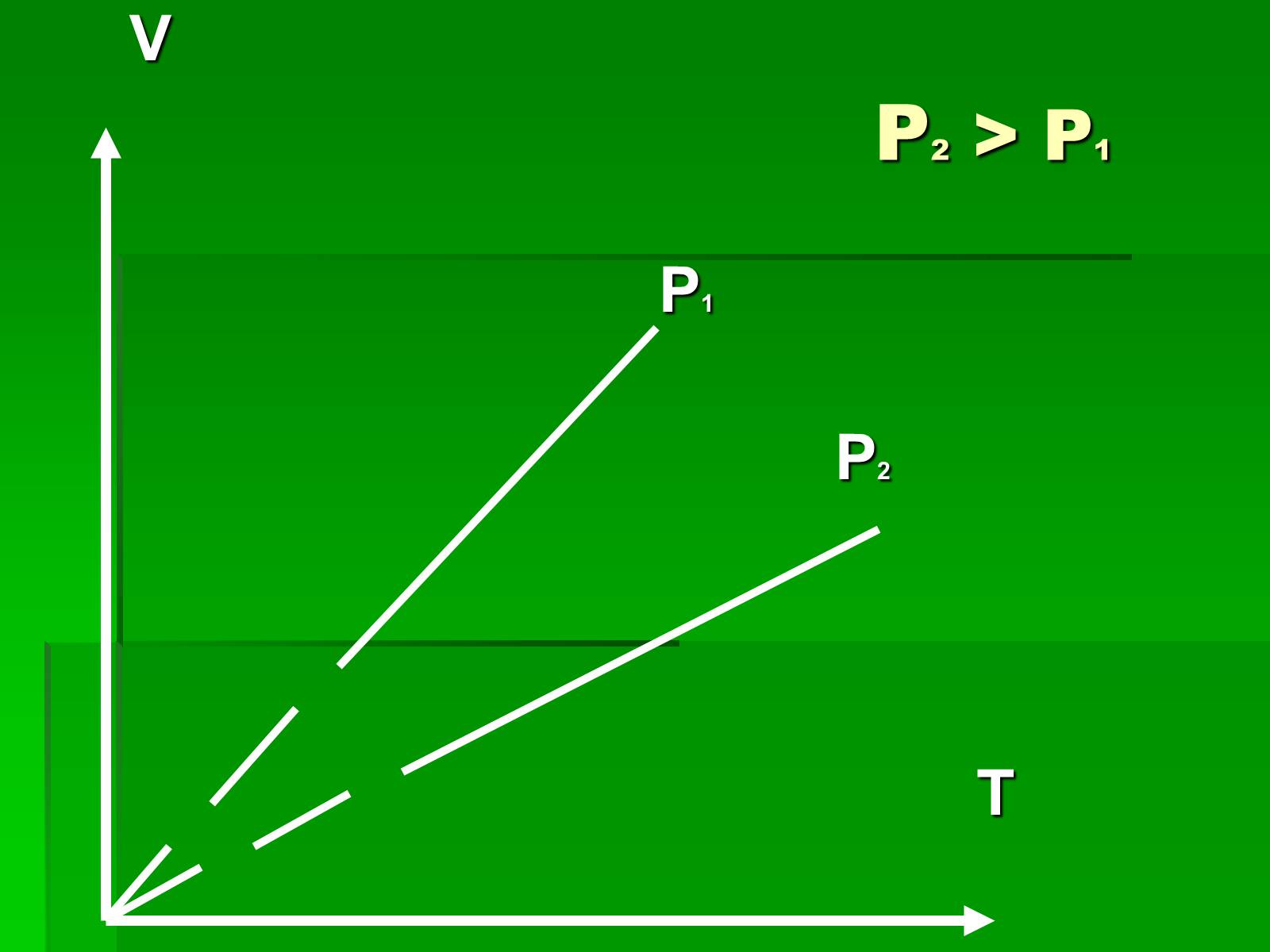
Графіки ізобарного процесу

Слайд #14
P2 > P1
V
P1
P2
T
V
P1
P2
T
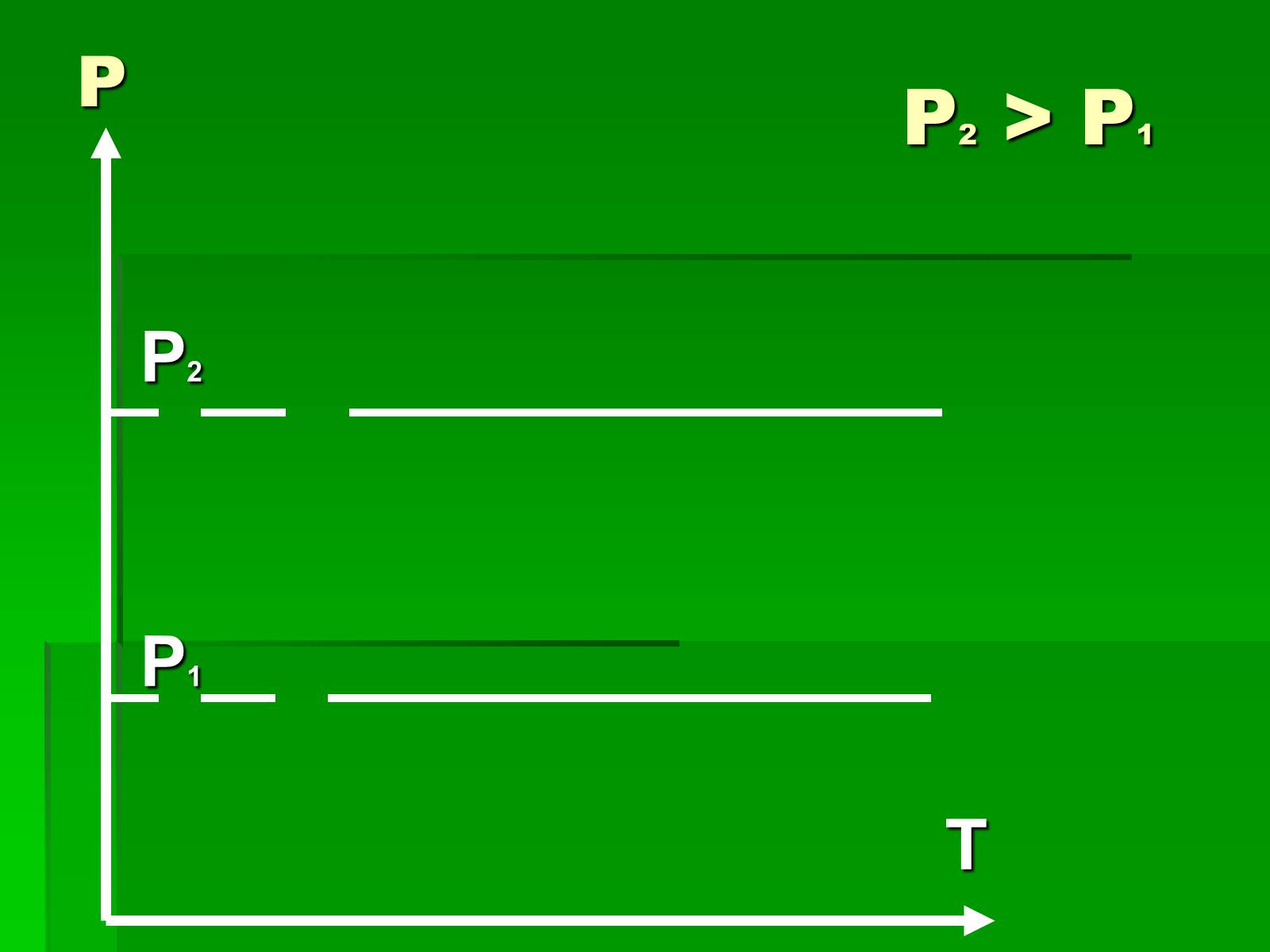
Слайд #15
P2
P1
T
P
Р2 > P1
P1
T
P
Р2 > P1
Слайд #16
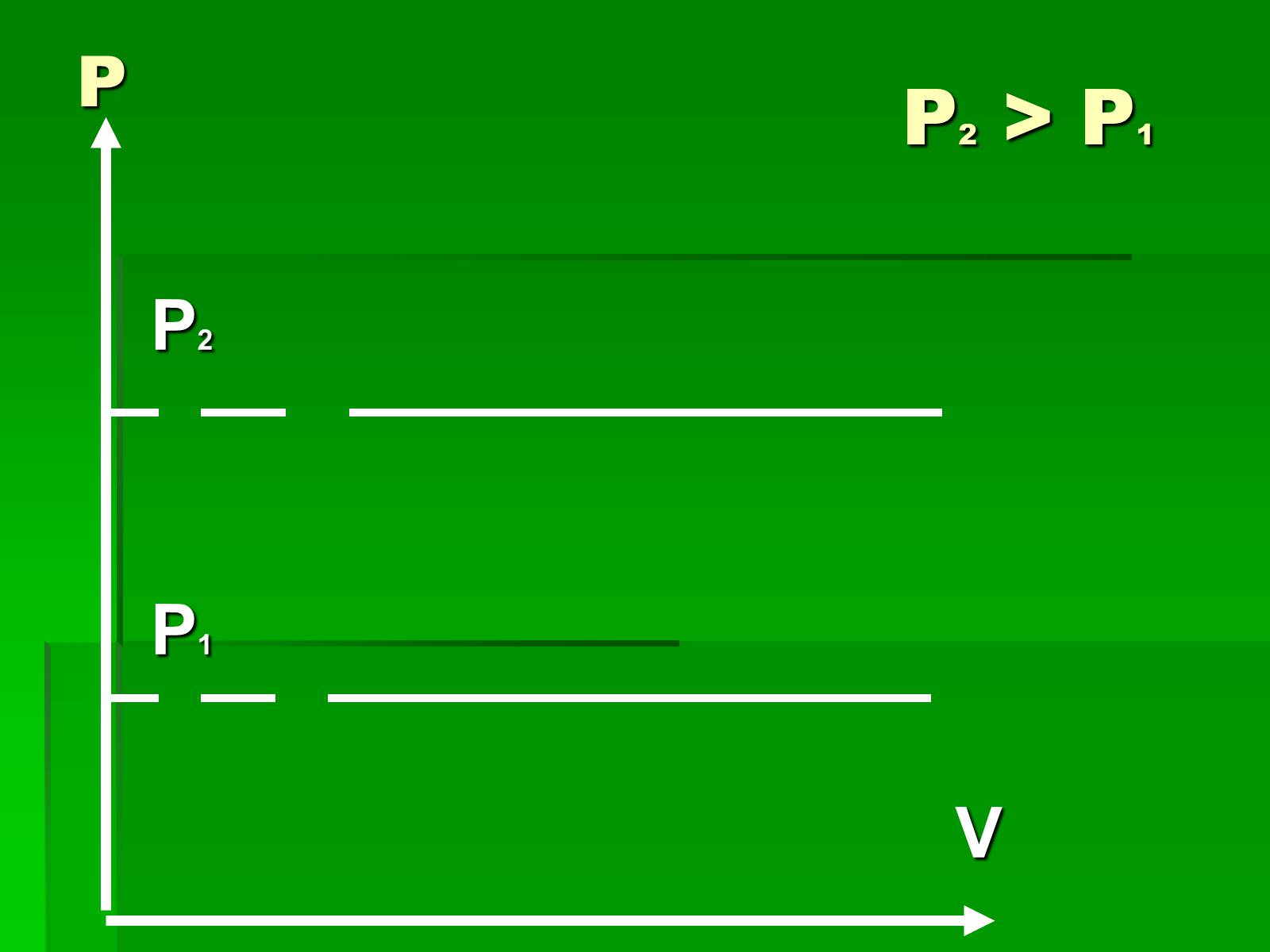
Р2 > P1
P2
P1
V
P
P2
P1
V
P
Слайд #17
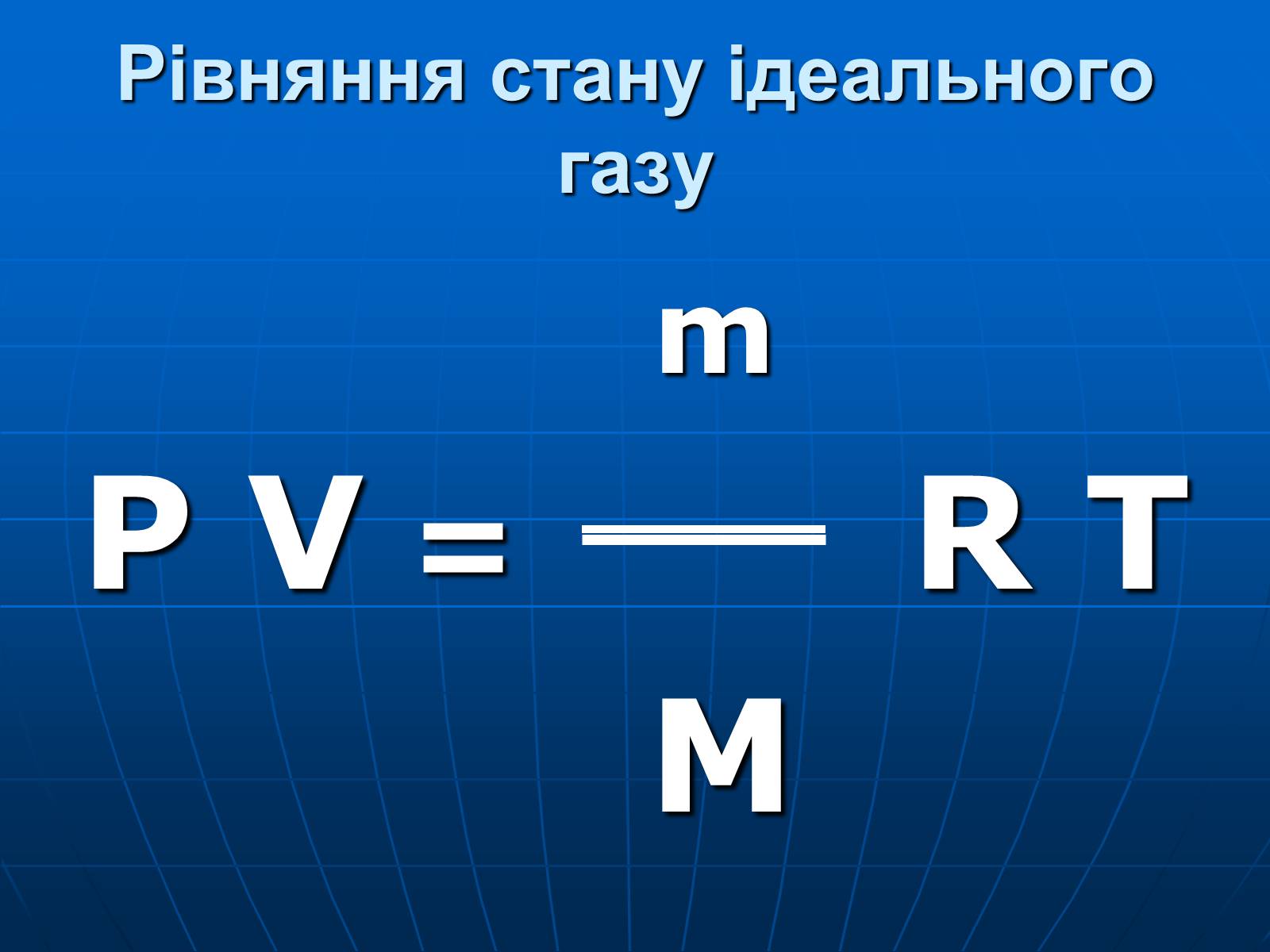
Рівняння стану ідеального газу
m
P V = R T
M
m
P V = R T
M
Слайд #18
Ізохорний процес
m = const
M = const
V = const
Закон Шарля
P
--- = const !!!
T
m = const
M = const
V = const
Закон Шарля
P
--- = const !!!
T

Слайд #19
Запам‘ятай! Це закон!
Закон Шарля: для даної маси газу та незмінного хімічного складу при сталому об'ємі відношення тиску газу до його абсолютної температури є величина стала ( тиск газу прямопропорційний його абсолютній температурі)
Закон Шарля: для даної маси газу та незмінного хімічного складу при сталому об'ємі відношення тиску газу до його абсолютної температури є величина стала ( тиск газу прямопропорційний його абсолютній температурі)

Слайд #20
Графіки ізохорного процесу

Слайд #21
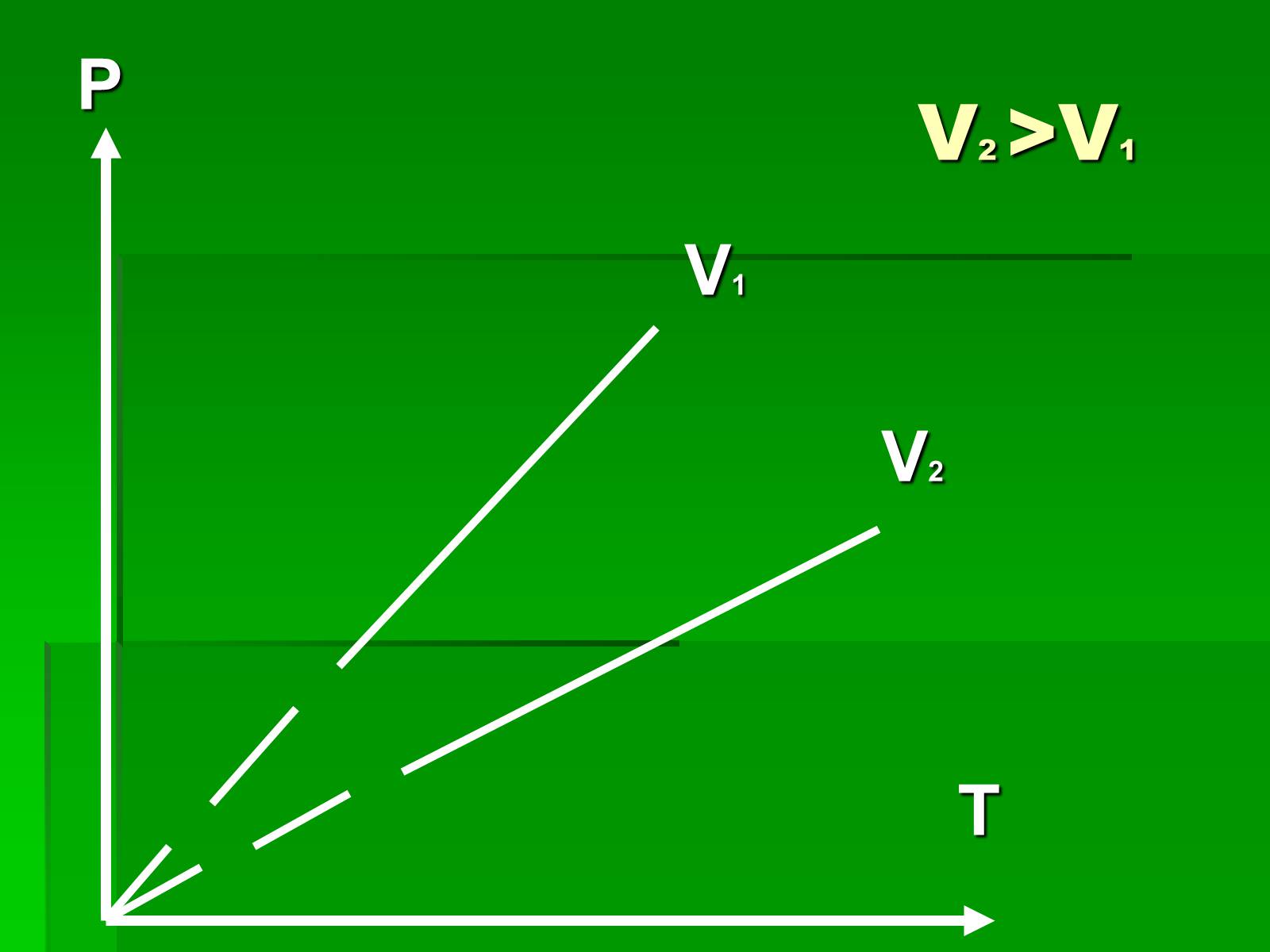
V2 >V1
P
V1
V2
T
P
V1
V2
T
Слайд #22
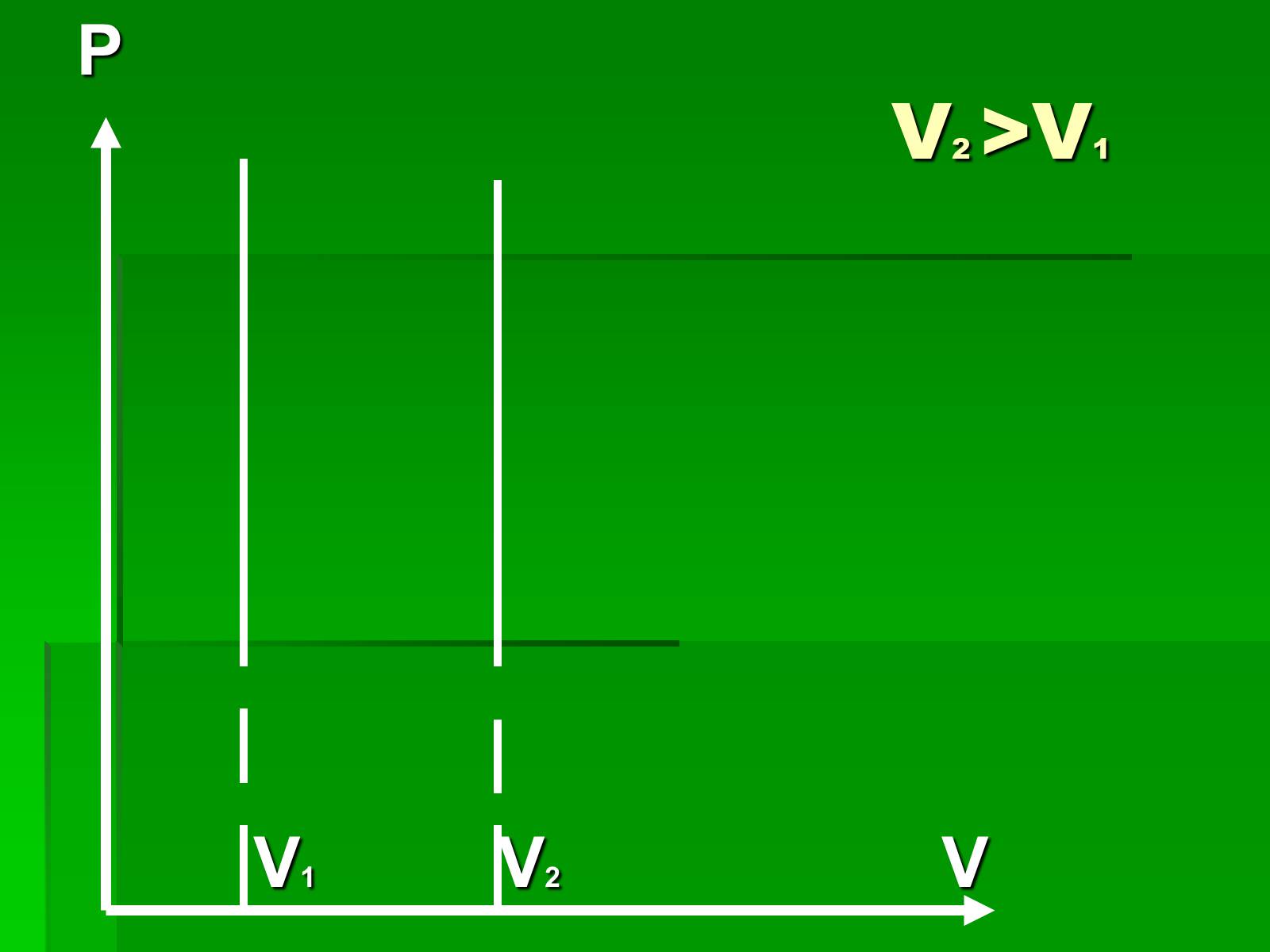
V2 >V1
P
V1 V2 V
P
V1 V2 V
Слайд #23
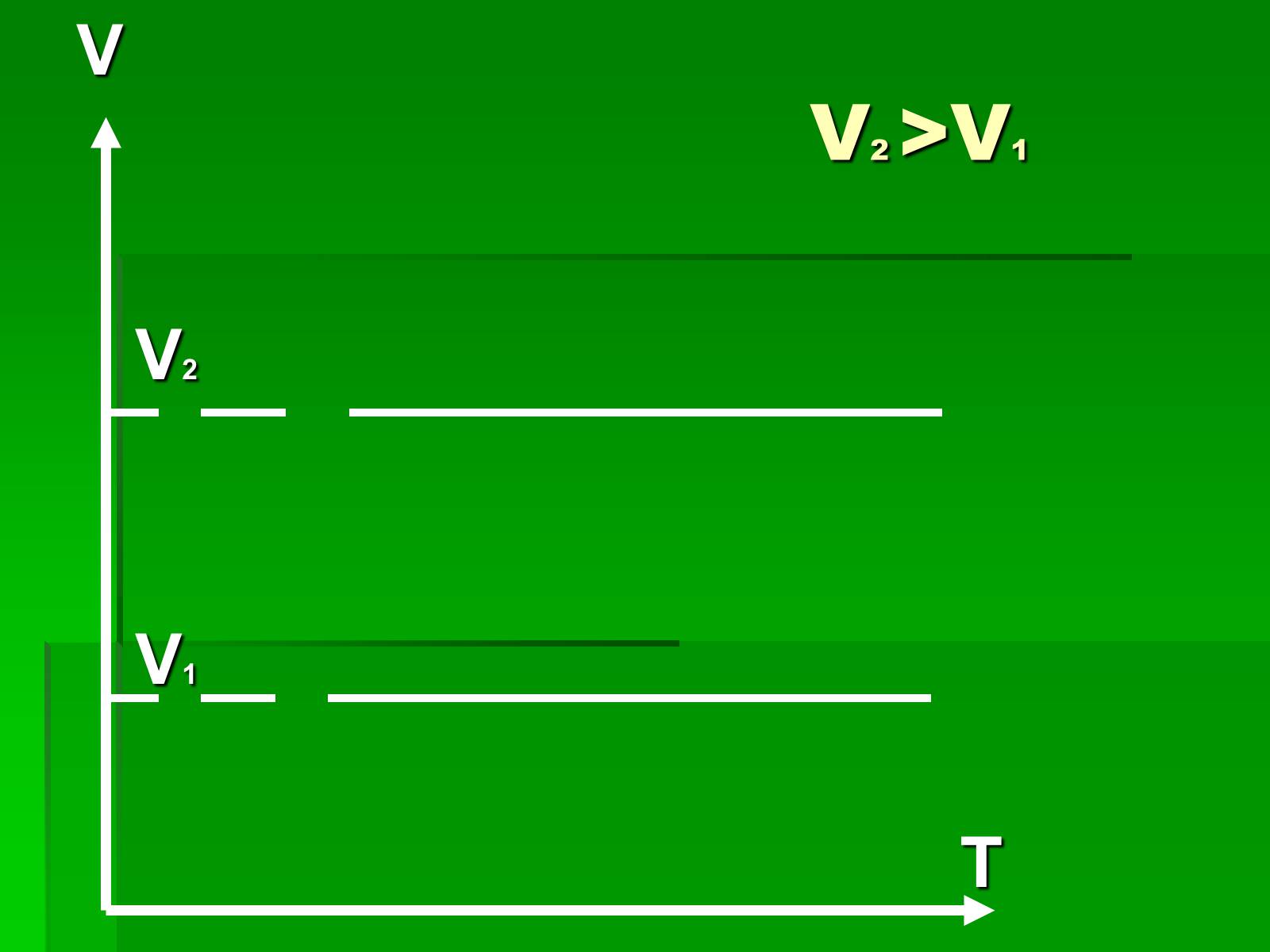
V2 >V1
V
V2
V1
T
V
V2
V1
T
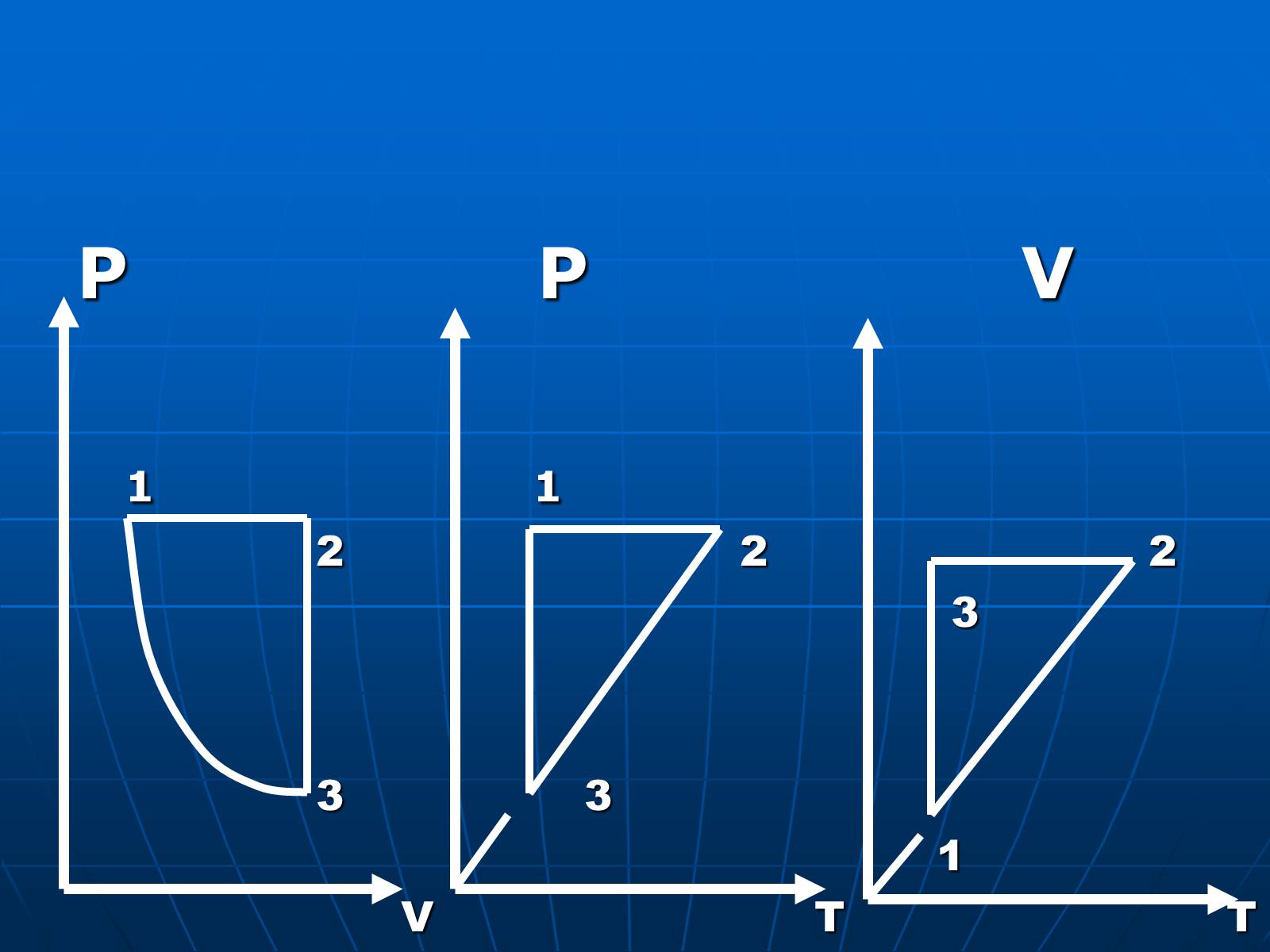
Слайд #24
P P V
1 1
2 2 2
3
3 3
1
V T T
1 1
2 2 2
3
3 3
1
V T T
Слайд #25
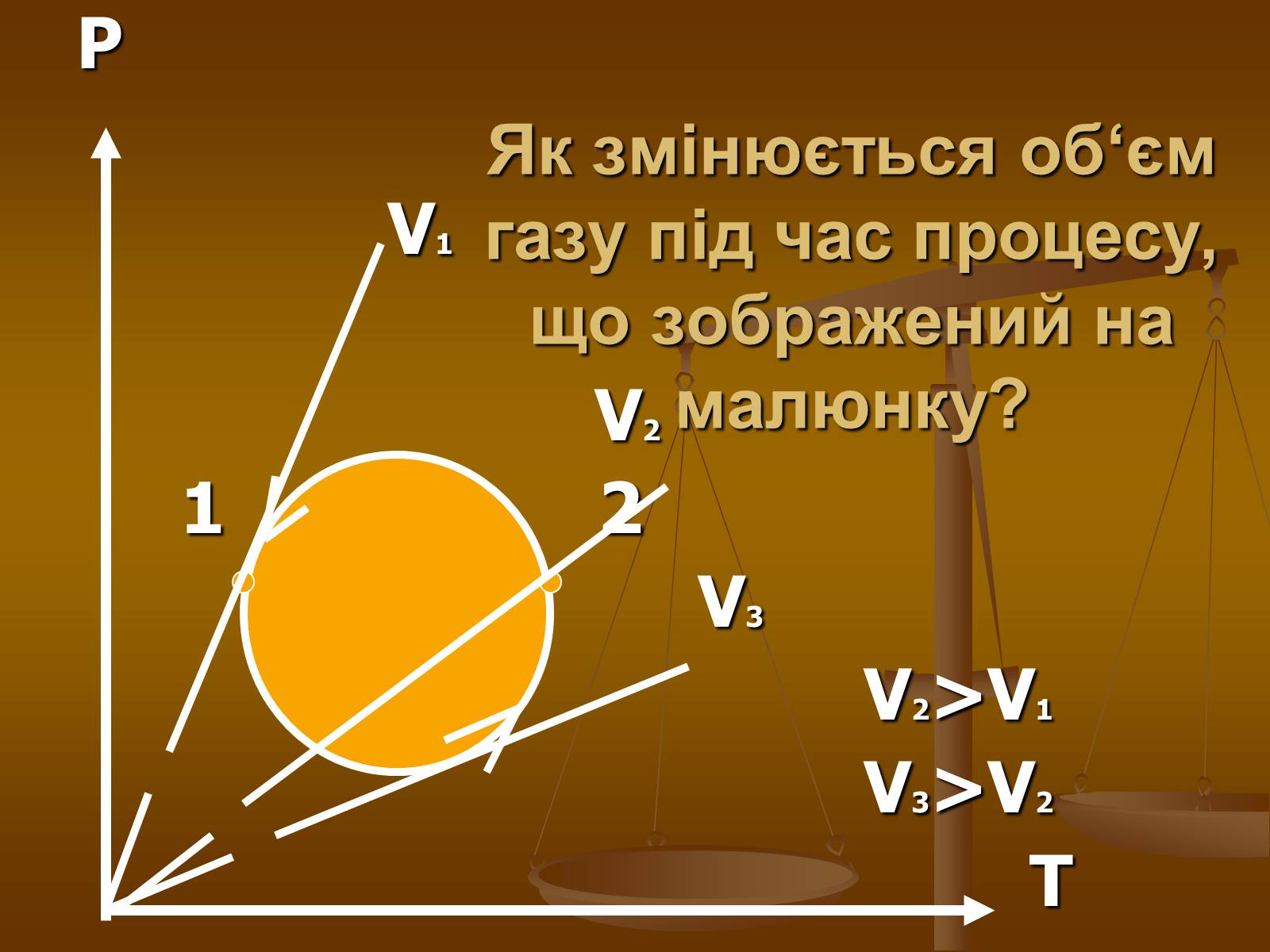
Як змінюється об‘єм газу під час процесу, що зображений на малюнку?
P
V1
V2
1 2
V3
V2>V1
V3>V2
T
P
V1
V2
1 2
V3
V2>V1
V3>V2
T