- Головна
- Готові шкільні презентації
- Презентація на тему «Ферум» (варіант 2)
Презентація на тему «Ферум» (варіант 2)
453
Слайд #1
Ферум /Залізо

Слайд #2
Ферум /Залізо
Слайд #3
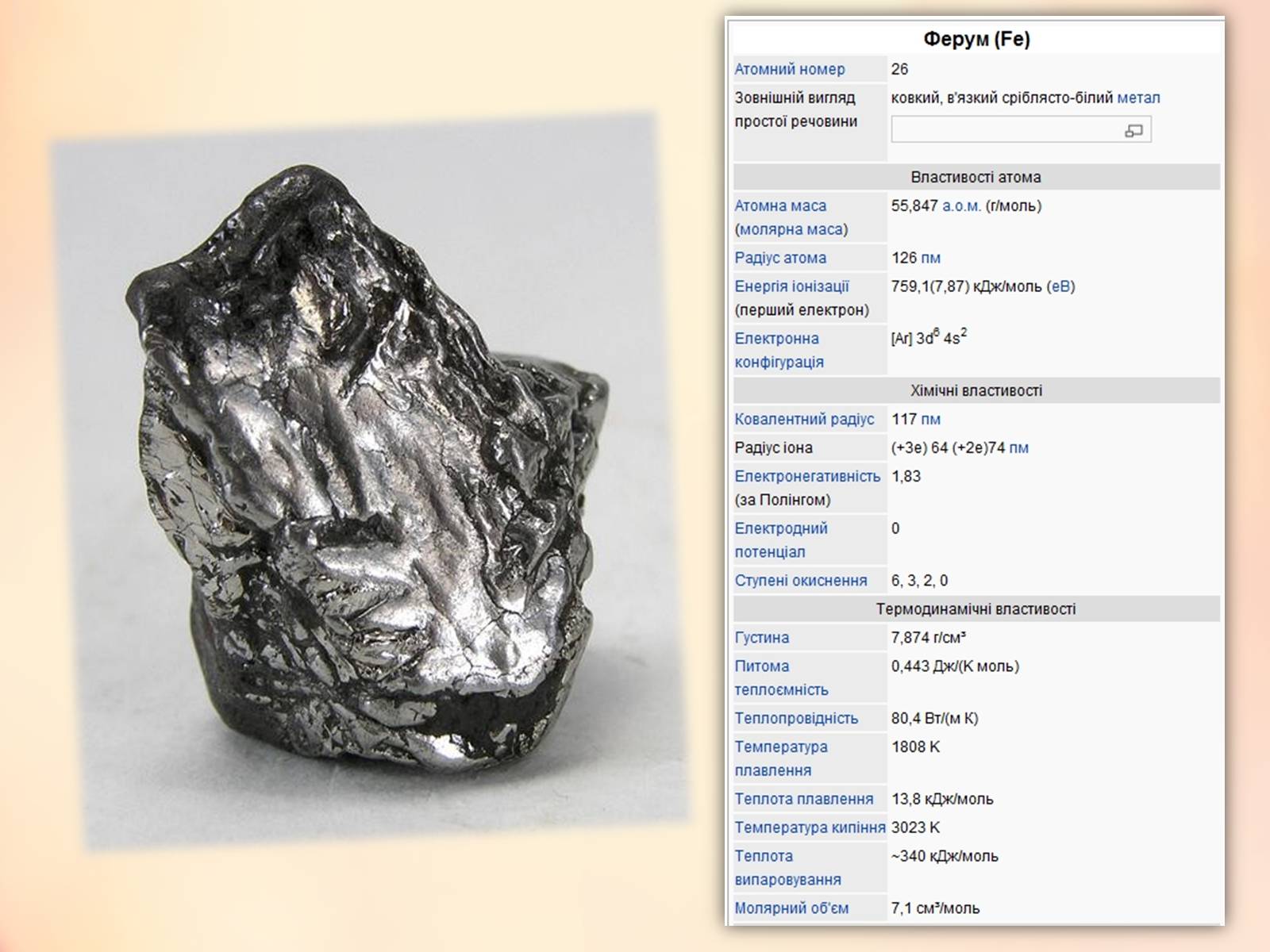
Ферум – d-елемент VІІІБ групи (або побічної підгрупи VІІІ групи) періодичної системи.
Будова атома: 26Fe)2)8)14)2
Електронна конфігурація атома Феруму: 1s22s22p62s23p63d64s2
Розміщення електронів зовнішнього і передостаннього енергетичних рівнів за енергетичними комірками:
В атомі Феруму вісім валентних електонів (3d64s2), тому він виявляє змінні ступені окиснення.
Найхарактерніші ступені окиснення +2 і +3
Будова атома Феруму
Будова атома: 26Fe)2)8)14)2
Електронна конфігурація атома Феруму: 1s22s22p62s23p63d64s2
Розміщення електронів зовнішнього і передостаннього енергетичних рівнів за енергетичними комірками:
В атомі Феруму вісім валентних електонів (3d64s2), тому він виявляє змінні ступені окиснення.
Найхарактерніші ступені окиснення +2 і +3
Будова атома Феруму

Слайд #4
Поширення в природі
За поширеністю у природі ферум посідає друге місце серед металів (після алюмінію). На нього припадає 5,10 % маси земної кори. За вмістом у земній корі ферум посідає 4-е місце.
Найважливішими природними сполуками феруму, що мають промислове значення, є магнітний залізняк Fe3O4, червоний залізняк Fe2O3, бурий залізняк Fe2O3 · nH2O та пірит FeS2. Оксиди феруму служать рудами, з яких добувають залізо, а пірит — сировиною для сульфатно-кислотного виробництва.
Гідротермальне джерело з високим вмістом заліза
Найважливіші мінерали феруму: гематит Fe2O3 (70 % Fe), магнетит Fe3O4 (72,4 % Fe), ґетит FeOOH (62,9 % Fe), лепідокрокіт FeO(OH) (62,9 % Fe), лімоніт — суміш гідрооксидів Fe з SiO2 та ін. речовинами (40-62 % Fe), сидерит FeCO3 (48,2 % Fe), ільменіт FeTiO3 (36,8 % Fe), шамозит (34-42 % FeO), вівіаніт (43,0 % FeO), скородит (34,6 % Fe2О3), ярозит (47,9 % Fe2О3) та ін.
За поширеністю у природі ферум посідає друге місце серед металів (після алюмінію). На нього припадає 5,10 % маси земної кори. За вмістом у земній корі ферум посідає 4-е місце.
Найважливішими природними сполуками феруму, що мають промислове значення, є магнітний залізняк Fe3O4, червоний залізняк Fe2O3, бурий залізняк Fe2O3 · nH2O та пірит FeS2. Оксиди феруму служать рудами, з яких добувають залізо, а пірит — сировиною для сульфатно-кислотного виробництва.
Гідротермальне джерело з високим вмістом заліза
Найважливіші мінерали феруму: гематит Fe2O3 (70 % Fe), магнетит Fe3O4 (72,4 % Fe), ґетит FeOOH (62,9 % Fe), лепідокрокіт FeO(OH) (62,9 % Fe), лімоніт — суміш гідрооксидів Fe з SiO2 та ін. речовинами (40-62 % Fe), сидерит FeCO3 (48,2 % Fe), ільменіт FeTiO3 (36,8 % Fe), шамозит (34-42 % FeO), вівіаніт (43,0 % FeO), скородит (34,6 % Fe2О3), ярозит (47,9 % Fe2О3) та ін.

Слайд #5
Залізо — блискучий сріблясто-білий важкий метал.
Густина його 7,86 т/м³;
температура плавлення 1538 °C, температура кипіння 2862 °C. Залізо досить пластичне. Воно легко кується, штампується, витягується в дріт і вальцюється в тонкі листи, легко намагнічується і розмагнічується. Вище температури Кюрі (770 °C) втрачає феромагнітні властивості. До температури 912 °C існує в алотропній модифікації α-заліза з об'ємноцентрованою кубічною кристалічною ґраткою, за вищої температури — γ-заліза із гранецентрованою кубічною ґраткою, вище 1394 °C знову змінює тип ґратки на об'ємноцентровану кубічну (δ-залізо).
Фізичні властивості
Густина його 7,86 т/м³;
температура плавлення 1538 °C, температура кипіння 2862 °C. Залізо досить пластичне. Воно легко кується, штампується, витягується в дріт і вальцюється в тонкі листи, легко намагнічується і розмагнічується. Вище температури Кюрі (770 °C) втрачає феромагнітні властивості. До температури 912 °C існує в алотропній модифікації α-заліза з об'ємноцентрованою кубічною кристалічною ґраткою, за вищої температури — γ-заліза із гранецентрованою кубічною ґраткою, вище 1394 °C знову змінює тип ґратки на об'ємноцентровану кубічну (δ-залізо).
Фізичні властивості

Слайд #6
Хімічні властивості
Ферум належить до восьмої групи періодичної системи елементів Менделєєва. Його атоми на зовнішній електронній оболонці мають по два електрони, а на передостанній — 14 електронів. Атоми феруму можуть легко втрачати два електрони і перетворюватись у двовалентні катіони Fe2+. Вони можуть втрачати і три електрони (один з передостанньої оболонки) і перетворюватись у тривалентні катіони Fe3+. Таким чином, залізо утворює два ряди сполук. Сполуки тривалентного феруму стійкіші.
У сухому повітрі за звичайної температури залізо досить стійке, але у вологому швидко іржавіє, вкриваючись товстим шаром іржі. Іржа є сумішшю оксидів і гідроксидів феруму. Основну частину іржі складає сесквіоксид заліза Fe2O3 і тригідроксид заліза Fe(OH)3. Крім того, до її складу входить монооксид заліза FeO, дигідроксид заліза Fe(OH)2 та інші сполуки.
Процес ржавіння заліза можна зобразити такими приблизними рівняннями:
2Fe + O2 + 2Н2О = 2Fe(OH)2
4Fe(OH)2 + O2 + 2Н2О = 4Fe(OH)3
Fe(OH)2 = FeO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Ферум належить до восьмої групи періодичної системи елементів Менделєєва. Його атоми на зовнішній електронній оболонці мають по два електрони, а на передостанній — 14 електронів. Атоми феруму можуть легко втрачати два електрони і перетворюватись у двовалентні катіони Fe2+. Вони можуть втрачати і три електрони (один з передостанньої оболонки) і перетворюватись у тривалентні катіони Fe3+. Таким чином, залізо утворює два ряди сполук. Сполуки тривалентного феруму стійкіші.
У сухому повітрі за звичайної температури залізо досить стійке, але у вологому швидко іржавіє, вкриваючись товстим шаром іржі. Іржа є сумішшю оксидів і гідроксидів феруму. Основну частину іржі складає сесквіоксид заліза Fe2O3 і тригідроксид заліза Fe(OH)3. Крім того, до її складу входить монооксид заліза FeO, дигідроксид заліза Fe(OH)2 та інші сполуки.
Процес ржавіння заліза можна зобразити такими приблизними рівняннями:
2Fe + O2 + 2Н2О = 2Fe(OH)2
4Fe(OH)2 + O2 + 2Н2О = 4Fe(OH)3
Fe(OH)2 = FeO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O

Слайд #7
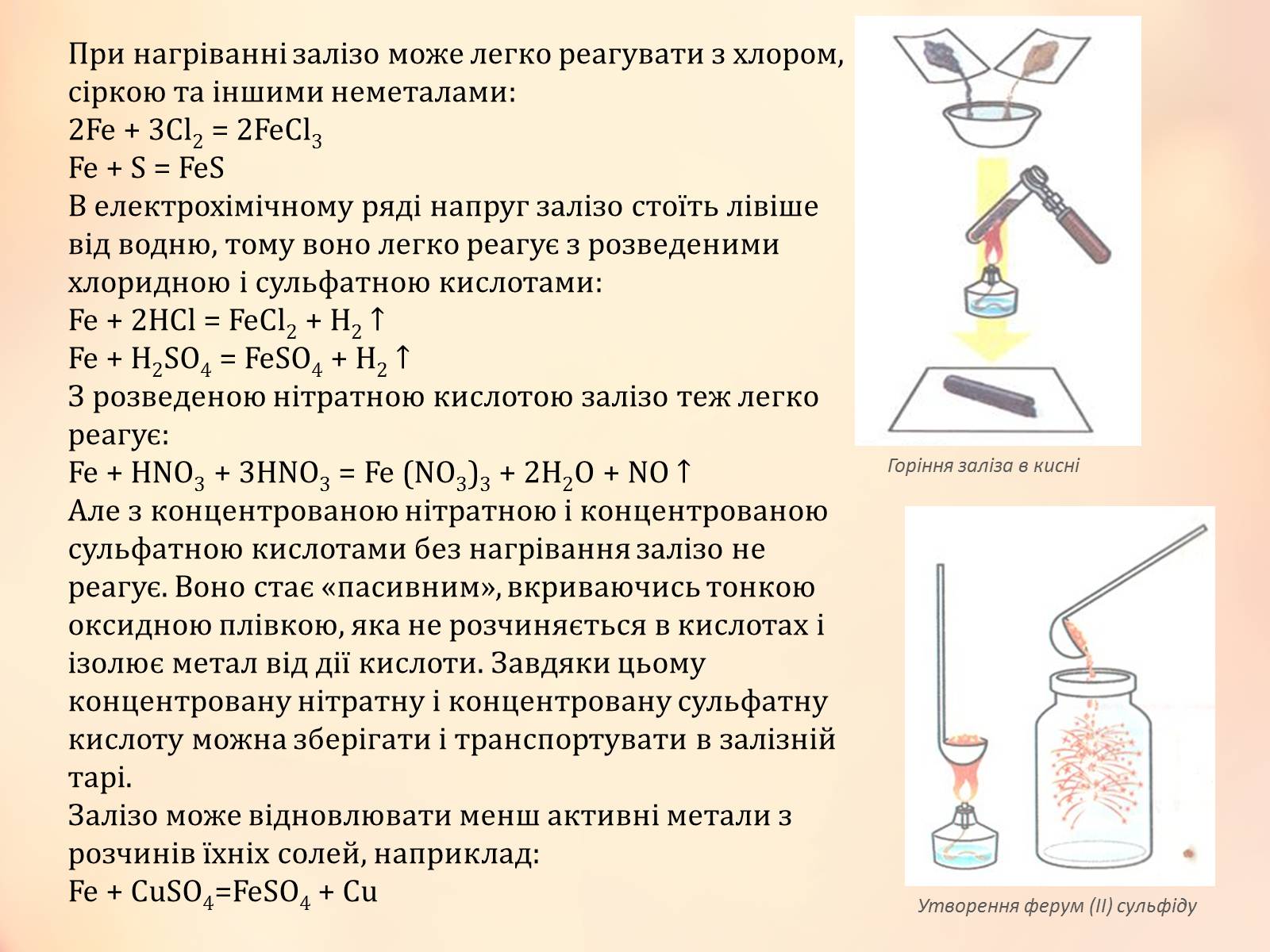
При нагріванні залізо може легко реагувати з хлором, сіркою та іншими неметалами:
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
В електрохімічному ряді напруг залізо стоїть лівіше від водню, тому воно легко реагує з розведеними хлоридною і сульфатною кислотами:
Fe + 2HCl = FeCl2 + Н2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
З розведеною нітратною кислотою залізо теж легко реагує:
Fe + HNO3 + 3HNO3 = Fe (NO3)3 + 2H2O + NO ↑
Але з концентрованою нітратною і концентрованою сульфатною кислотами без нагрівання залізо не реагує. Воно стає «пасивним», вкриваючись тонкою оксидною плівкою, яка не розчиняється в кислотах і ізолює метал від дії кислоти. Завдяки цьому концентровану нітратну і концентровану сульфатну кислоту можна зберігати і транспортувати в залізній тарі.
Залізо може відновлювати менш активні метали з розчинів їхніх солей, наприклад:
Fe + CuSO4=FeSO4 + Cu
Горіння заліза в кисні
Утворення ферум (II) сульфіду
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
В електрохімічному ряді напруг залізо стоїть лівіше від водню, тому воно легко реагує з розведеними хлоридною і сульфатною кислотами:
Fe + 2HCl = FeCl2 + Н2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
З розведеною нітратною кислотою залізо теж легко реагує:
Fe + HNO3 + 3HNO3 = Fe (NO3)3 + 2H2O + NO ↑
Але з концентрованою нітратною і концентрованою сульфатною кислотами без нагрівання залізо не реагує. Воно стає «пасивним», вкриваючись тонкою оксидною плівкою, яка не розчиняється в кислотах і ізолює метал від дії кислоти. Завдяки цьому концентровану нітратну і концентровану сульфатну кислоту можна зберігати і транспортувати в залізній тарі.
Залізо може відновлювати менш активні метали з розчинів їхніх солей, наприклад:
Fe + CuSO4=FeSO4 + Cu
Горіння заліза в кисні
Утворення ферум (II) сульфіду
Слайд #8
Цікаві перетворення сполук Феруму
Якісні реакції на сполуки Fe2+ та Fe3+
Реакція солі тривалентного Феруму (Fe2(SO4)3) з тіоцианатом (роданідом) калію (KSCN) настільки видовищна, що її часто використовують для імітації крові. При взаємодії йонів Fe3+ та SCN- (часто пишуть CNS- або NCS- ) утворюється комплекс (спрощено можна записати його формулу як [Fe(SCN)3]), який дуже нагадує кров (навіть за консистенцією!). Отже, цю реакцію можна використовувати не лише для якісного визначення йонів Fe3+, а для імітації крові. Реакція надзвичайно чутлива і за її допомогою можна визначити навіть сліди Fe3+ у воді з водогону.
Взаємодія ферум(ІІІ) хлориду з калій тіоцианатом
Якісні реакції на сполуки Fe2+ та Fe3+
Реакція солі тривалентного Феруму (Fe2(SO4)3) з тіоцианатом (роданідом) калію (KSCN) настільки видовищна, що її часто використовують для імітації крові. При взаємодії йонів Fe3+ та SCN- (часто пишуть CNS- або NCS- ) утворюється комплекс (спрощено можна записати його формулу як [Fe(SCN)3]), який дуже нагадує кров (навіть за консистенцією!). Отже, цю реакцію можна використовувати не лише для якісного визначення йонів Fe3+, а для імітації крові. Реакція надзвичайно чутлива і за її допомогою можна визначити навіть сліди Fe3+ у воді з водогону.
Взаємодія ферум(ІІІ) хлориду з калій тіоцианатом

Слайд #9
Використання жовтої та червоної кров'яних солей
Жовта кров'яна сіль (калій гексаціаноферат (ІІ) K4[Fe (CN)6]) – реактив на Fe3+:
FeCl3 + K4[Fe (CN)6] =KFe[Fe (CN)6] + 3KCl
або в йонному вигляді
Fe3+ + [Fe(CN)6]4− → Fe[Fe(CN)6] −
Утворюється осад синього кольору , який називають «берлінська лазур».
Якісна реакція на солі тривалентного Феруму
Червона кров'яна сіль (калій гексаціаноферат (ІІІ) K3[Fe (CN)6]) - реактив на Fe2+
в результаті реакції утворюється речовина синього кольору «турнбулева синь».
4Fe2+ + 3[Fe(CN)6]3− → FeIII4[FeII(CN)6]3↓
Якісна реакція на солі двовалентного Феруму
Жовта кров'яна сіль (калій гексаціаноферат (ІІ) K4[Fe (CN)6]) – реактив на Fe3+:
FeCl3 + K4[Fe (CN)6] =KFe[Fe (CN)6] + 3KCl
або в йонному вигляді
Fe3+ + [Fe(CN)6]4− → Fe[Fe(CN)6] −
Утворюється осад синього кольору , який називають «берлінська лазур».
Якісна реакція на солі тривалентного Феруму
Червона кров'яна сіль (калій гексаціаноферат (ІІІ) K3[Fe (CN)6]) - реактив на Fe2+
в результаті реакції утворюється речовина синього кольору «турнбулева синь».
4Fe2+ + 3[Fe(CN)6]3− → FeIII4[FeII(CN)6]3↓
Якісна реакція на солі двовалентного Феруму

Слайд #10
Раніше вважали, що берлінська лазур і турнбулева синь – різні речовини, зараз вже відомо, що в обох випадках утворюється синій продукт однакового складу і будови KFeIII[FeII(CN)6], в процесі реакції відбувається майже миттєва валентна перебудова.
"Турнбулева синь"
"Берлінська лазур"
"Турнбулева синь"
"Берлінська лазур"

Слайд #11
Чисте залізо має досить обмежене застосування. Його використовують при виготовленні сердечників електромагнітів та якорів електромашин, як каталізатор хімічних процесів, для виготовлення анодних пластин залізо-нікелевих акумуляторів. Карбонільне залізо використовують для нанесення найтонших плівок і шарів на магнітофонні стрічки і диски носіїв постійної пам'яті, як антианемічний засіб та ін.
Застосування
Залізний порошок використовують при зварюванні, а також для цементації міді.
Залізовуглецеві сплави чавун і сталь — основний конструкційний матеріал, що застосовується у всіх галузях промисловості. Виробництво заліза та його сплавів становить більше 90 % виробництва всіх металів і утворює окрему галузь промисловості — чорну металургію.
Сталі містять до 2,14 % карбону, чавун — понад 2,14 %. Фундаментом науки про сталь і чавун, як сплави заліза з вуглецем є діаграма стану сплавів залізо-вуглець — графічне відображення фазового стану сплавів заліза з вуглецем в залежності від їх хімічного складу і температури.
Застосування
Залізний порошок використовують при зварюванні, а також для цементації міді.
Залізовуглецеві сплави чавун і сталь — основний конструкційний матеріал, що застосовується у всіх галузях промисловості. Виробництво заліза та його сплавів становить більше 90 % виробництва всіх металів і утворює окрему галузь промисловості — чорну металургію.
Сталі містять до 2,14 % карбону, чавун — понад 2,14 %. Фундаментом науки про сталь і чавун, як сплави заліза з вуглецем є діаграма стану сплавів залізо-вуглець — графічне відображення фазового стану сплавів заліза з вуглецем в залежності від їх хімічного складу і температури.

Слайд #12
Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься десь 4 г Феруму. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Нестача Феруму призводить до небезпечної хвороби — недокрів'я. Тому обов'язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо.
Біологічна роль заліза
Біологічна роль заліза

Слайд #13
Цікаві факти про залізо
Які істоти винні в кольорі Кривавого водоспаду в Антарктиді?
В Антарктиді з льодовика Тейлора часом виходить Кривавий водоспад. Вода в ньому містить двовалентне залізо, яке, з'єднуючись з атмосферним повітрям, окислюється і утворює іржу. Це і надає водоспаду криваво-рудий колір. Однак двовалентне залізо у воді виникає не просто так - його виробляють бактерії, що живуть в ізольованому від зовнішнього світу водоймі глибоко під льодом. Ці бактерії зуміли організувати життєвий цикл при повній відсутності сонячного світла і кисню. Вони переробляють залишки органіки, а «дихають» тривалентні залізом з навколишніх порід.
Різнобарвний метал з візерунком
Немає нічого незвичайного в тому, що будь-який з відомих нам металів, піддаючись будь-якої обробці, може змінювати колір. Колір того чи іншого металу залежить і від ступеня нагріву, і від самої обробки, і від хімічних властивостей. Але неможливо уявити блакитне золото або червоне срібло. Навпаки, залізо, а відповідно, і сталь, і чавун у всіх своїх «іпостасях» мають незрівнянну ні з яким іншим металом колірну палітру. У холодному стані воно може бути сірим і чорним, майже білим, блакитним і синім, золотавим і червонуватим. Більше того, залізо є єдиним металом, який може сам себе прикрашати декоративним орнаментом, що проступає як би зсередини. Варіанти цього фактурного орнаменту нескінченні, і їх не можна зарахувати до жодного із загальновідомих, так як цей малюнок народжується самим металом.
Які істоти винні в кольорі Кривавого водоспаду в Антарктиді?
В Антарктиді з льодовика Тейлора часом виходить Кривавий водоспад. Вода в ньому містить двовалентне залізо, яке, з'єднуючись з атмосферним повітрям, окислюється і утворює іржу. Це і надає водоспаду криваво-рудий колір. Однак двовалентне залізо у воді виникає не просто так - його виробляють бактерії, що живуть в ізольованому від зовнішнього світу водоймі глибоко під льодом. Ці бактерії зуміли організувати життєвий цикл при повній відсутності сонячного світла і кисню. Вони переробляють залишки органіки, а «дихають» тривалентні залізом з навколишніх порід.
Різнобарвний метал з візерунком
Немає нічого незвичайного в тому, що будь-який з відомих нам металів, піддаючись будь-якої обробці, може змінювати колір. Колір того чи іншого металу залежить і від ступеня нагріву, і від самої обробки, і від хімічних властивостей. Але неможливо уявити блакитне золото або червоне срібло. Навпаки, залізо, а відповідно, і сталь, і чавун у всіх своїх «іпостасях» мають незрівнянну ні з яким іншим металом колірну палітру. У холодному стані воно може бути сірим і чорним, майже білим, блакитним і синім, золотавим і червонуватим. Більше того, залізо є єдиним металом, який може сам себе прикрашати декоративним орнаментом, що проступає як би зсередини. Варіанти цього фактурного орнаменту нескінченні, і їх не можна зарахувати до жодного із загальновідомих, так як цей малюнок народжується самим металом.

Слайд #14
Перше залізо, як метал, потрапило до рук людини «з неба». Не дарма люди вважали залізо - небесним металом, тому що вперше його добули з падаючих на поверхню землі метеоритів. У найдавніших предметах з заліза є істотна частка домішок нікелю, саме таке залізо міститься в метеоритах. Найбільший залізний метеорит знайшли в 1920 році в південно-західній Африці. Метеорит назвали «Гоба», він важив 60 тонн.
Залізо в організм тварин і людини надходить з їжею. Найбільш багаті залізом такі продукти, як м'ясо, печінка, яйця, бобові, крупи, хліб, буряк. Цікаво зауважити, що колись у цей список був помилково внесено шпинат (з причини друкарські помилки в записах результатів аналізу, а саме був загублений «зайвий» нуль після розділової коми).
Залізо в організм тварин і людини надходить з їжею. Найбільш багаті залізом такі продукти, як м'ясо, печінка, яйця, бобові, крупи, хліб, буряк. Цікаво зауважити, що колись у цей список був помилково внесено шпинат (з причини друкарські помилки в записах результатів аналізу, а саме був загублений «зайвий» нуль після розділової коми).

Слайд #15
Підготувала
учениця 10-Б класу
Безсмертна Вікторія
учениця 10-Б класу
Безсмертна Вікторія