- Головна
- Готові шкільні презентації
- Презентація на тему «Оксиди неметалічних елементів» (варіант 1)
Презентація на тему «Оксиди неметалічних елементів» (варіант 1)
324
Слайд #1
Оксиди неметалічних елементів. Кислотний характер оксидів та гідроксидів неметалічних елементів.

Слайд #2
Мета.
Порівняти склад оксидів сульфуру, нітрогену, фосфору, карбону і силіцію їх фізичні та хімічні властивості.
Узагальнити знання про кислоти як гідроксиди неметалічних елементів.
Пояснити суть парникового ефекту, причини кислотних дощів.
Ознайомити учнів з екологічними проблемами, викликаними наявністю цих сполук в навколишньому середовищі
Демонстрація № 5. Спалювання сірки і доведення кислотного характеру утвореного оксиду.
Порівняти склад оксидів сульфуру, нітрогену, фосфору, карбону і силіцію їх фізичні та хімічні властивості.
Узагальнити знання про кислоти як гідроксиди неметалічних елементів.
Пояснити суть парникового ефекту, причини кислотних дощів.
Ознайомити учнів з екологічними проблемами, викликаними наявністю цих сполук в навколишньому середовищі
Демонстрація № 5. Спалювання сірки і доведення кислотного характеру утвореного оксиду.

Слайд #3
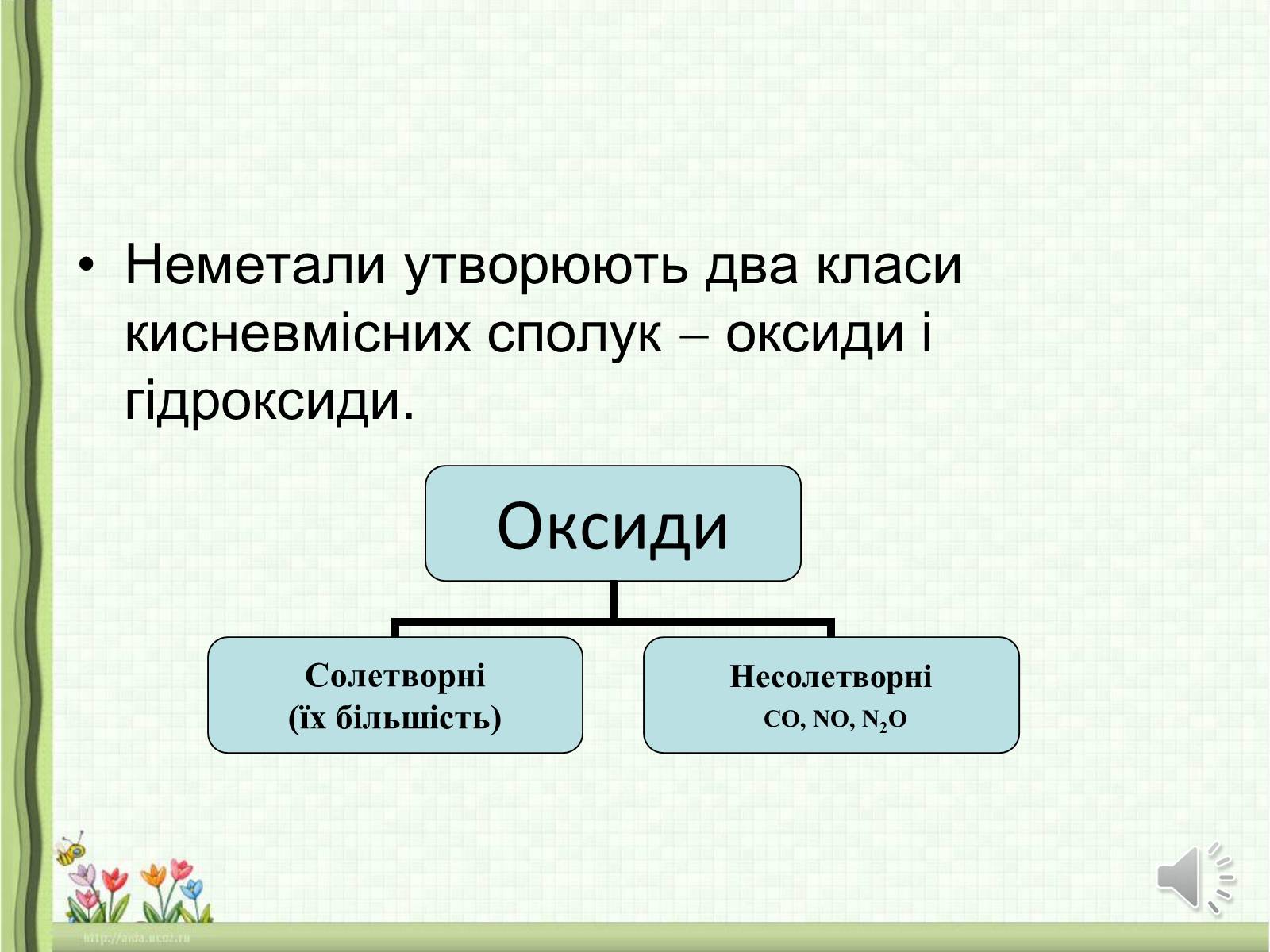
Неметали утворюють два класи кисневмісних сполук оксиди і гідроксиди.
Слайд #4
Будова сполук.
Майже всі оксиди неметалічних елементів складаються з молекул. У них ковалентні зв'язки між атомами є полярними, а самі молекули можуть бути полярними і неполярними.
Майже всі оксиди неметалічних елементів складаються з молекул. У них ковалентні зв'язки між атомами є полярними, а самі молекули можуть бути полярними і неполярними.

Слайд #5
Оксиди неметалічних елементів.
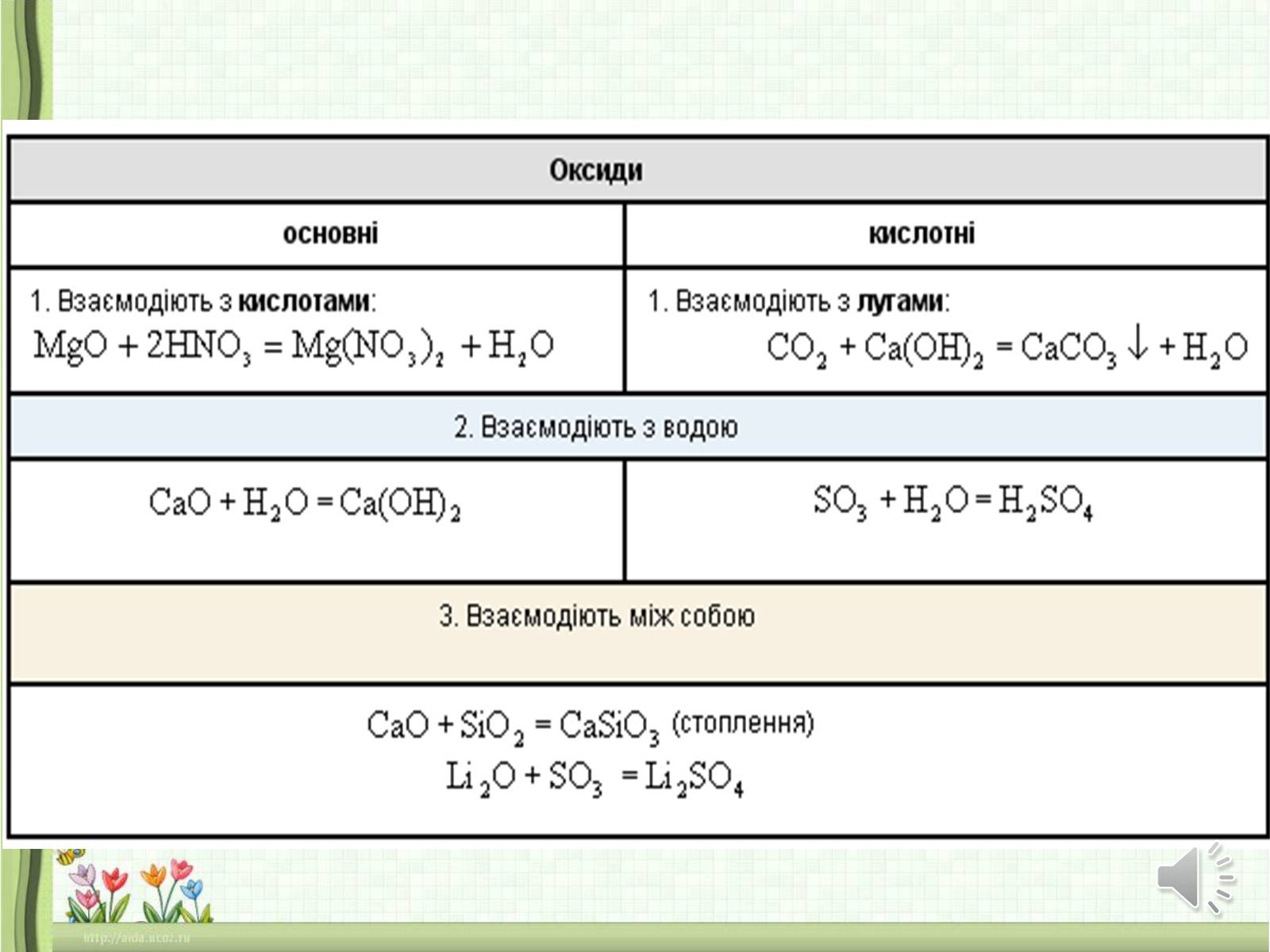
Мають кислотний характер
Більшість із них розчиняється у воді з утворенням відповідних кислот, тому їх називають ангідридами кислот:
СO2 + Н2O Н2СO3
SО3 + Н2О Н2SО4
Мають кислотний характер
Більшість із них розчиняється у воді з утворенням відповідних кислот, тому їх називають ангідридами кислот:
СO2 + Н2O Н2СO3
SО3 + Н2О Н2SО4

Слайд #6
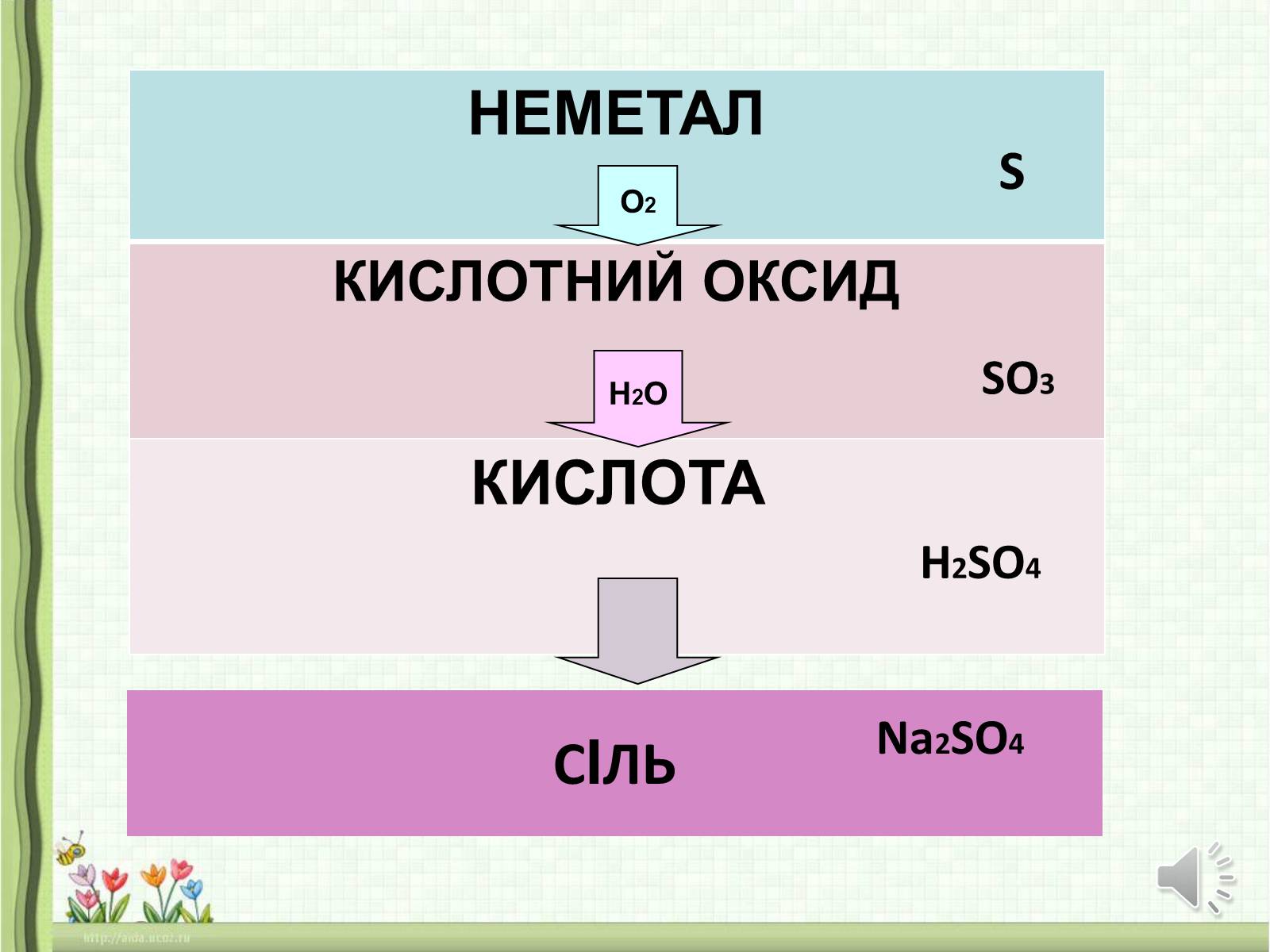
НЕМЕТАЛ
КИСЛОТНИЙ ОКСИД
КИСЛОТА
СІЛЬ
S
SO3
H2SO4
Na2SO4
О2
Н2О
КИСЛОТНИЙ ОКСИД
КИСЛОТА
СІЛЬ
S
SO3
H2SO4
Na2SO4
О2
Н2О
Слайд #7
НЕМЕТАЛ
КИСЛОТНИЙ ОКСИД
КИСЛОТА
СІЛЬ
S
SO3
H2SO4
Na2SO4
О2
Н2О
КИСЛОТНИЙ ОКСИД
КИСЛОТА
СІЛЬ
S
SO3
H2SO4
Na2SO4
О2
Н2О
Слайд #8
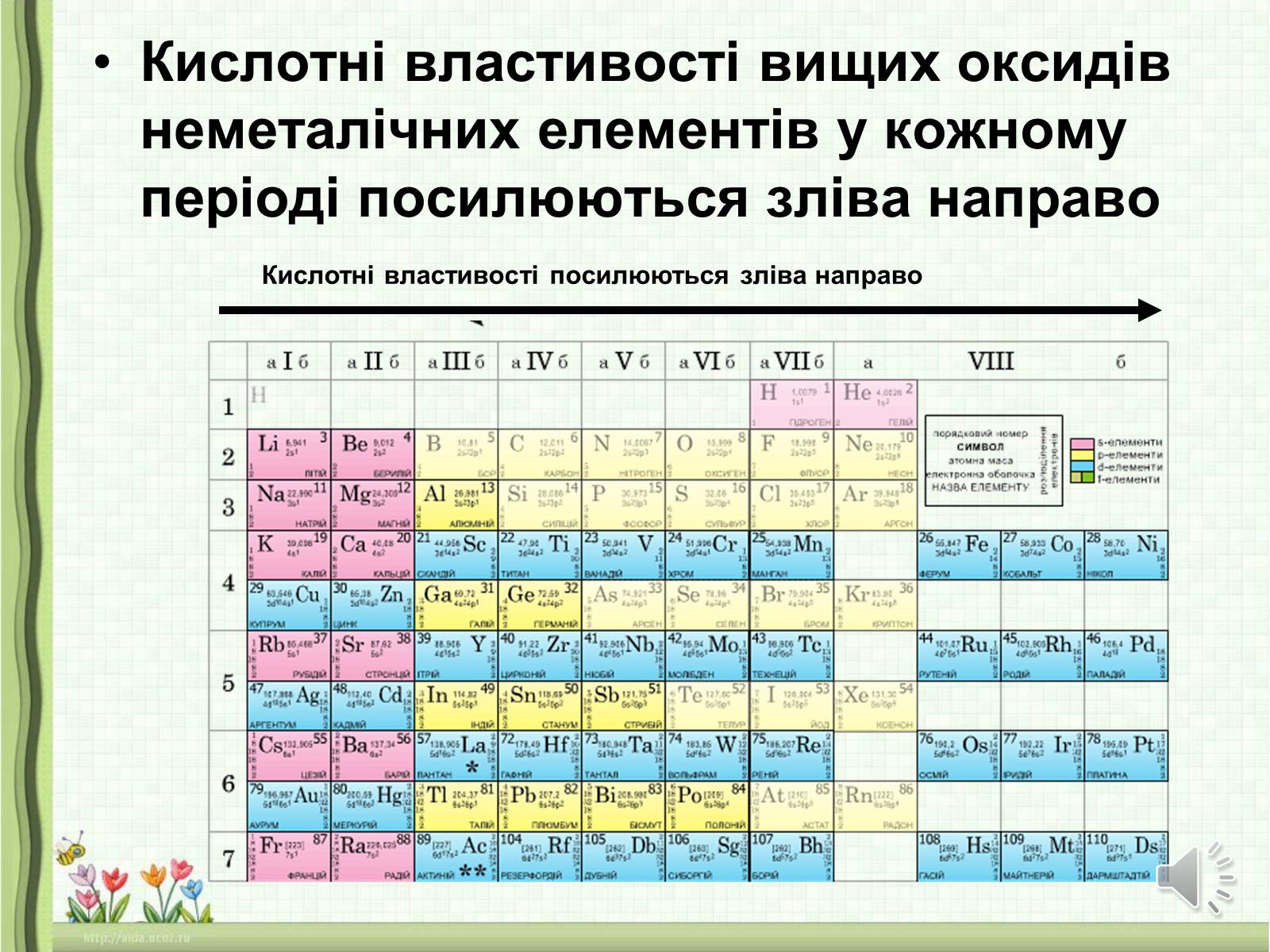
Кислотні властивості вищих оксидів неметалічних елементів у кожному періоді посилюються зліва направо
Кислотні властивості посилюються зліва направо
Кислотні властивості посилюються зліва направо
Слайд #9
У такому самому напрямку збільшується і сила відповідних кислот.
Наприклад, оксид SiO2 не взаємодіє з водою, а P2O5 активно вступає в реакцію з нею; кислота H2SiO3 є дуже слабкою, а H3PO4 належить до кислот середньої сили.
Існує ще одна закономірність: чим вища валентність неметалічного елемента в оксиді, тим більшою мірою виражені кислотні властивості в оксиду і відповідної кислоти.
Так, за звичайних умов реакція оксиду SO2 з водою є оборотною, а оксид SO3 взаємодіє з нею повністю; кислота H2SO3 належить до кислот середньої сили, а H2SO4— сильна.
Наприклад, оксид SiO2 не взаємодіє з водою, а P2O5 активно вступає в реакцію з нею; кислота H2SiO3 є дуже слабкою, а H3PO4 належить до кислот середньої сили.
Існує ще одна закономірність: чим вища валентність неметалічного елемента в оксиді, тим більшою мірою виражені кислотні властивості в оксиду і відповідної кислоти.
Так, за звичайних умов реакція оксиду SO2 з водою є оборотною, а оксид SO3 взаємодіє з нею повністю; кислота H2SO3 належить до кислот середньої сили, а H2SO4— сильна.

Слайд #10
Допишіть схеми реакцій і складіть хімічні рівняння:
SO2 + O2→
CO2 + MgO →
CO2 + LiOH →
SO3 + H2O →
BaCO3 + SiO2→
CaCO3 + P2O5→
SO2 + O2→
CO2 + MgO →
CO2 + LiOH →
SO3 + H2O →
BaCO3 + SiO2→
CaCO3 + P2O5→

Слайд #11
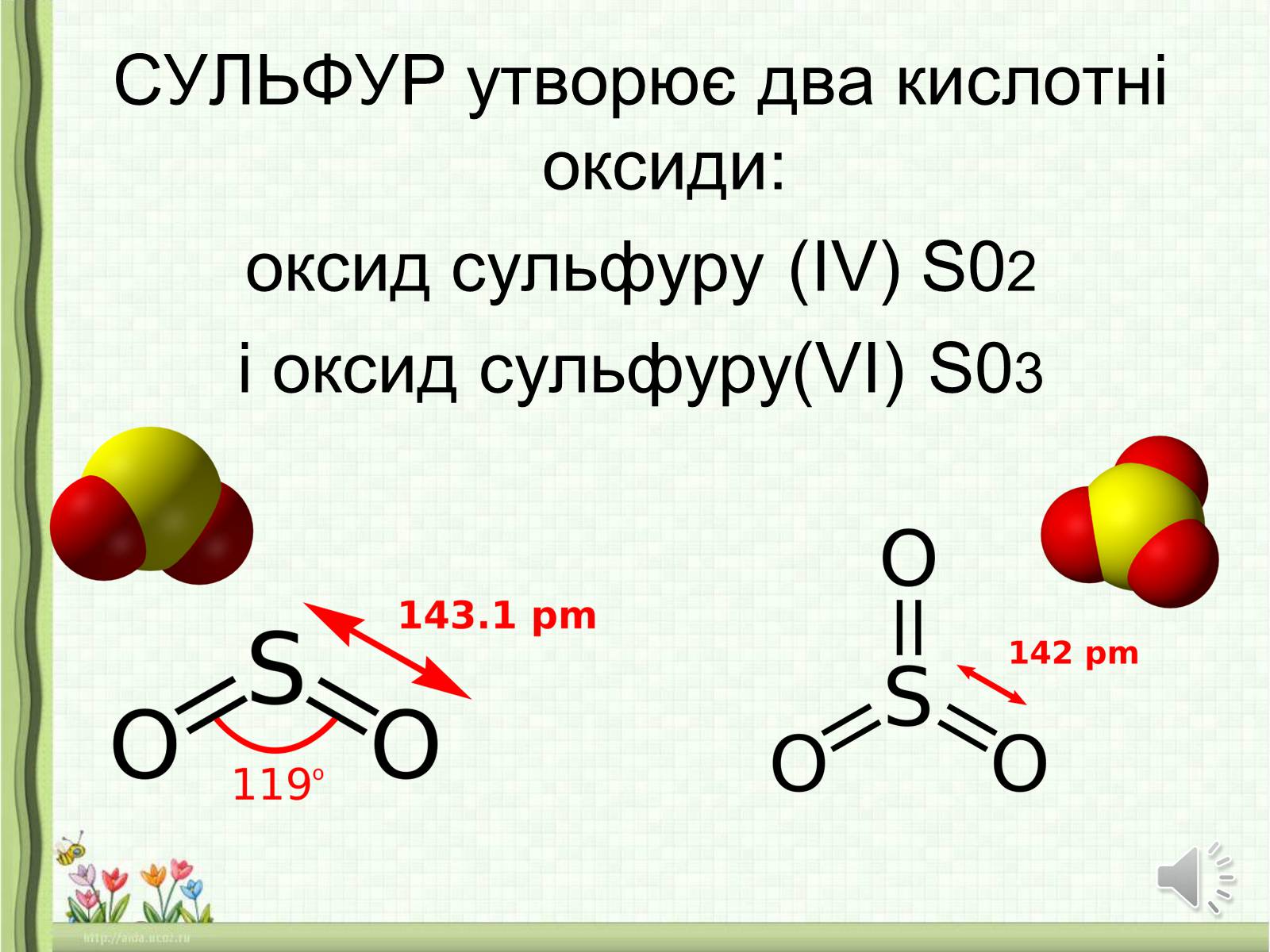
СУЛЬФУР утворює два кислотні оксиди:
оксид сульфуру (ІV) S02
і оксид сульфуру(VI) S03
оксид сульфуру (ІV) S02
і оксид сульфуру(VI) S03
Слайд #12
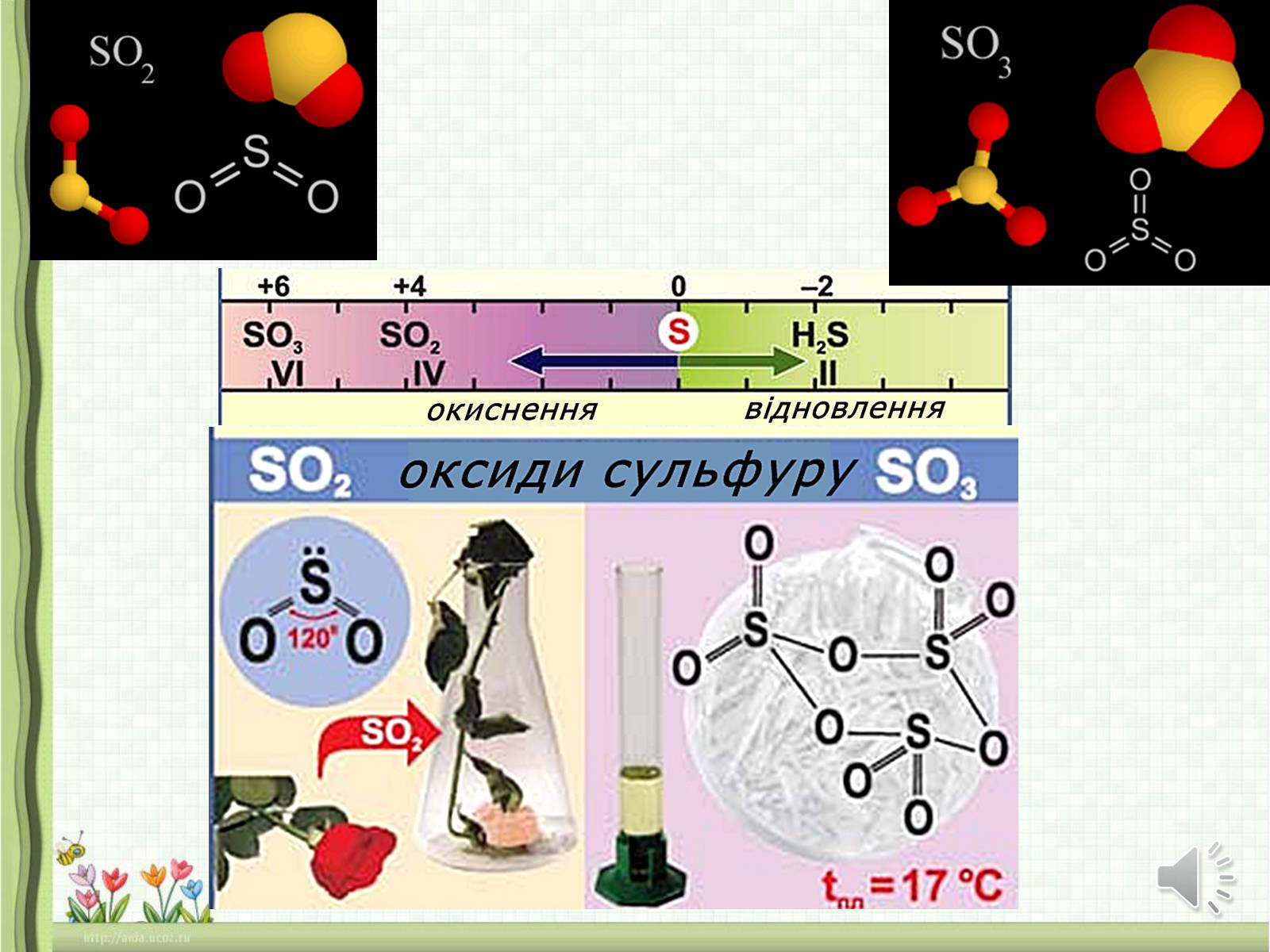
СУЛЬФУР утворює два кислотні оксиди:
оксид сульфуру (ІV) S02
і оксид сульфуру(VI) S03
оксид сульфуру (ІV) S02
і оксид сульфуру(VI) S03
Слайд #13
Оксид сульфуру(IV) SO2 (діоксид сульфуру, сірчистий газ) — це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Токсичний
Дуже легко розчиняється у воді (в 1 л води при 20 °С Розчиняється 43 л S02).
Поряд з «фізичним» розчиненням одночасно відбувається хімічна взаємодія невеликої частини молекул оксиду сульфуру(ІV) S02 з водою, внаслідок чого утворюється сульфітна кислота:
S02 + Н20 = H2S03
Оксид сульфуру (IV) добувають спалюванням сірки, a також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад:
S + O2 = SO2↑
2Pb + 3O2 = 2PbO + 2SO2↑
Оксид сульфуру (VІ) S03(триоксид сульфуру) — безбарвна рідина, яка за температури, нижчої від 17 °С, кристалізується, перетворюючись на довгі шовковисті кристали.
Дуже летка речовина, сильний окисник. Токсичний, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки шкіри, енергійно руйнує органічні сполуки.
Зберігають його у запаяних скляних посудинах.
Оксид сульфуру (VІ) на повітрі димить, бурхливо взаємодіє з водою з виділенням великої кількості теплоти, утворюючи сульфатну кислоту:
S03 + Н20 = H2S04
Добувають оксид сульфуру(VI) у результаті окиснення S02 киснем повітря
Дуже легко розчиняється у воді (в 1 л води при 20 °С Розчиняється 43 л S02).
Поряд з «фізичним» розчиненням одночасно відбувається хімічна взаємодія невеликої частини молекул оксиду сульфуру(ІV) S02 з водою, внаслідок чого утворюється сульфітна кислота:
S02 + Н20 = H2S03
Оксид сульфуру (IV) добувають спалюванням сірки, a також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад:
S + O2 = SO2↑
2Pb + 3O2 = 2PbO + 2SO2↑
Оксид сульфуру (VІ) S03(триоксид сульфуру) — безбарвна рідина, яка за температури, нижчої від 17 °С, кристалізується, перетворюючись на довгі шовковисті кристали.
Дуже летка речовина, сильний окисник. Токсичний, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки шкіри, енергійно руйнує органічні сполуки.
Зберігають його у запаяних скляних посудинах.
Оксид сульфуру (VІ) на повітрі димить, бурхливо взаємодіє з водою з виділенням великої кількості теплоти, утворюючи сульфатну кислоту:
S03 + Н20 = H2S04
Добувають оксид сульфуру(VI) у результаті окиснення S02 киснем повітря

Слайд #14
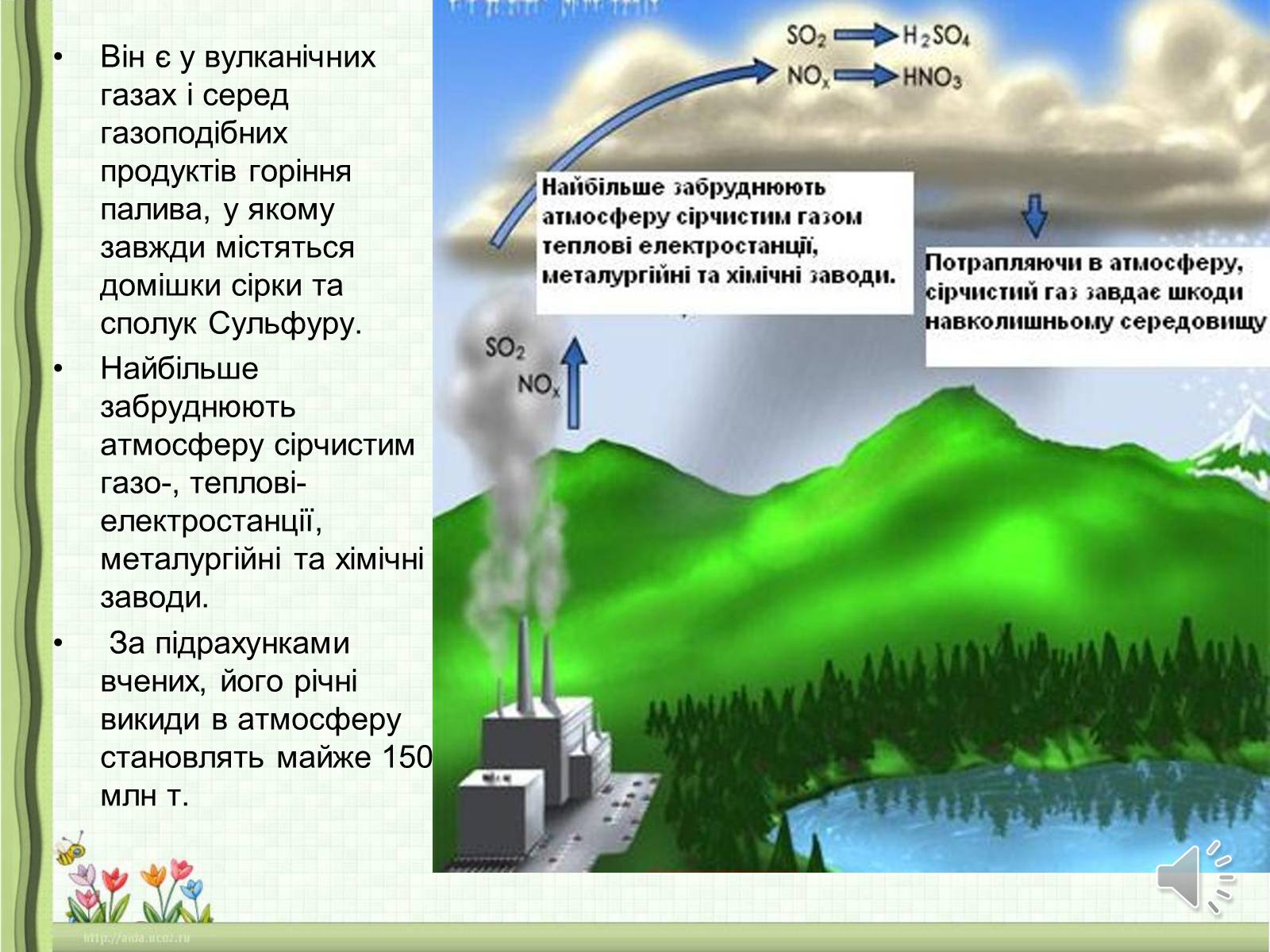
Він є у вулканічних газах і серед газоподібних продуктів горіння палива, у якому завжди містяться домішки сірки та сполук Сульфуру.
Найбільше забруднюють атмосферу сірчистим газо-, теплові- електростанції, металургійні та хімічні заводи.
За підрахунками вчених, його річні викиди в атмосферу становлять майже 150 млн т.
Найбільше забруднюють атмосферу сірчистим газо-, теплові- електростанції, металургійні та хімічні заводи.
За підрахунками вчених, його річні викиди в атмосферу становлять майже 150 млн т.
Слайд #15
НІТРОГЕН З ОКСИГЕНОМ утворює п'ять оксидів, в яких він виявляє ступінь окиснення від +1 до +5:
+1 +2 +3 +4 +5
N20, NO, N203, N02, N2O5
Усі оксиди нітрогену дуже отруйні, за винятком N20.
+1 +2 +3 +4 +5
N20, NO, N203, N02, N2O5
Усі оксиди нітрогену дуже отруйні, за винятком N20.

Слайд #16
Усі оксиди нітрогену дуже отруйні, за винятком N20.
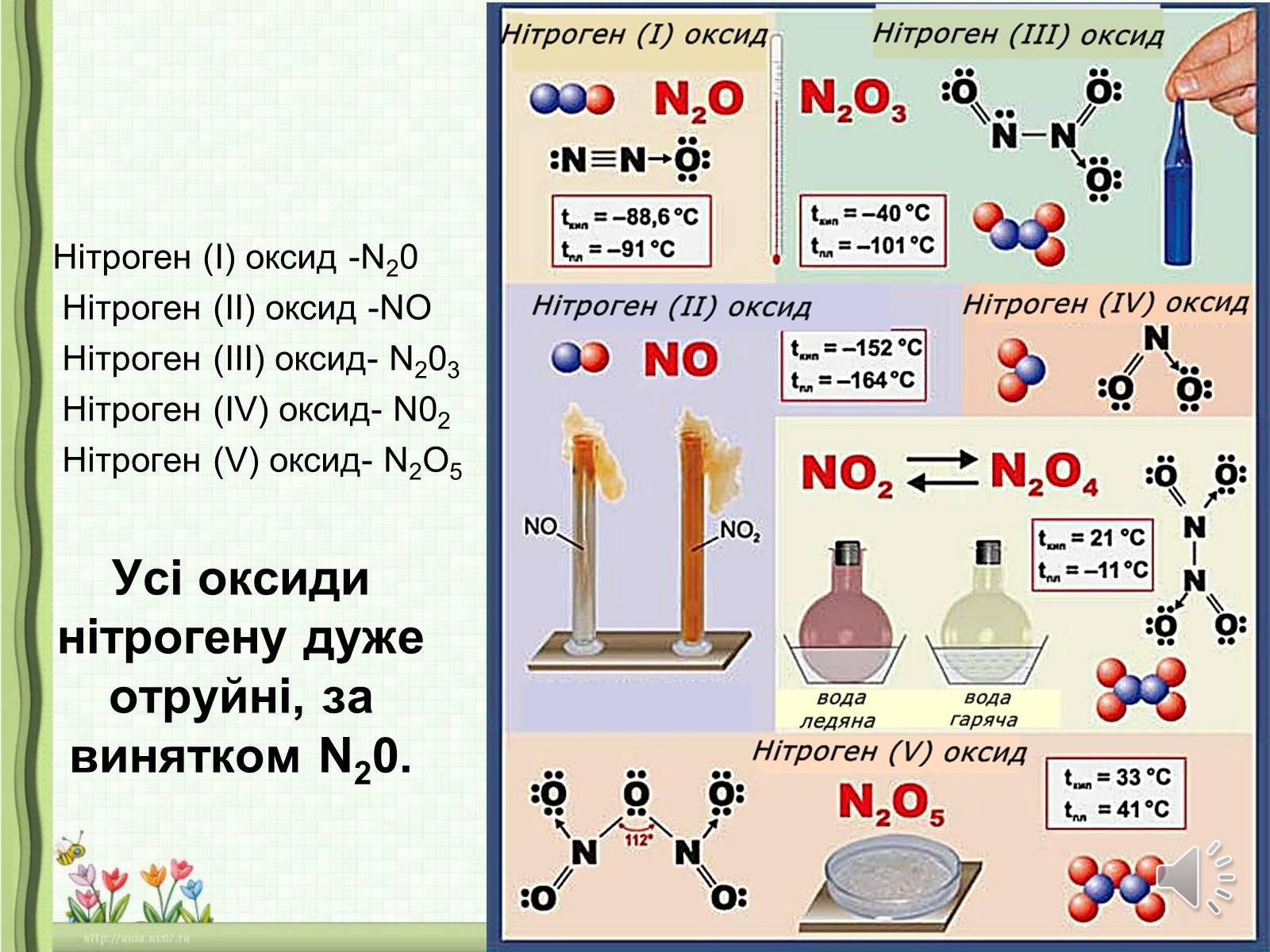
Нітроген (I) оксид -N20
Нітроген (II) оксид -NO
Нітроген (III) оксид- N203
Нітроген (IV) оксид- N02
Нітроген (V) оксид- N2O5
Нітроген (I) оксид -N20
Нітроген (II) оксид -NO
Нітроген (III) оксид- N203
Нітроген (IV) оксид- N02
Нітроген (V) оксид- N2O5
Слайд #17
Оксид нітрогену (І) N20 — безбарвний газ із приємним запахом, залежить до несолетвірних оксидів. Під назвою «веселильний газ» N20 у суміші з киснем використовується в медицині для наркозу. Не отруйний.
Оксид нітрогену (ІІ) NO — безбарвний газ, без запаху, у воді не розчиняється. Належить до несолетвірних оксидів.
На повітрі легко окиснюється, перетворюючись на бурий газ — діоксид нітрогену, або оксид нїтрогену (IV) N02:
2NO + 02 = 2N02
Оксид нітрогену (IV) N02 — бурий газ із характерним апахом. Належить до солетвірних (кислотних) оксидів. Добре розчиняється у воді, бо реагує з нею, утворюючи суміш двох кислот — нітратної і нітритної
2N02 + Н20 = HN03 + HN02
Оксид нітрогену(ІІІ) N203 — нестійка темно-синя рідина за низьких теператур, солетвірний (кислотний) оксид, розчиняючись у воді, утворює нітритну кислоту:
N2О3 + Н2О = 2HN02
Оксид нітрогену(V) N205 — білі кристали, також солетвірний (киcлотний) оксид, реагує з водою, утворюючи нітратну кислоту: N205 + H2О = 2HN03
Нітратна кислота являє собою сильну одноосновну кислоту.
Її солі — нітрати
Оксид нітрогену (ІІ) NO — безбарвний газ, без запаху, у воді не розчиняється. Належить до несолетвірних оксидів.
На повітрі легко окиснюється, перетворюючись на бурий газ — діоксид нітрогену, або оксид нїтрогену (IV) N02:
2NO + 02 = 2N02
Оксид нітрогену (IV) N02 — бурий газ із характерним апахом. Належить до солетвірних (кислотних) оксидів. Добре розчиняється у воді, бо реагує з нею, утворюючи суміш двох кислот — нітратної і нітритної
2N02 + Н20 = HN03 + HN02
Оксид нітрогену(ІІІ) N203 — нестійка темно-синя рідина за низьких теператур, солетвірний (кислотний) оксид, розчиняючись у воді, утворює нітритну кислоту:
N2О3 + Н2О = 2HN02
Оксид нітрогену(V) N205 — білі кристали, також солетвірний (киcлотний) оксид, реагує з водою, утворюючи нітратну кислоту: N205 + H2О = 2HN03
Нітратна кислота являє собою сильну одноосновну кислоту.
Її солі — нітрати

Слайд #18
2NO2 + H2O= HNO3 + НNO2

Слайд #19
Найбільше забруднення повітря нітроген(ІV) оксидом спричиняють автомобілі — під час згорання пального в циліндрах двигунів утворюється NO, а з нього — NO2.
«Лисячий хвіст» - жаргонна назва викидів в атмосферу нітроген (IV) оксиду на хімічних приємствах (іноді - з вихлопних труб старих автомобілів).
«Лисячий хвіст» - жаргонна назва викидів в атмосферу нітроген (IV) оксиду на хімічних приємствах (іноді - з вихлопних труб старих автомобілів).

Слайд #20
З оксидів фосфору
Р205 і Р203
найбільше значення має оксид фосфору(V).
Р205 і Р203
найбільше значення має оксид фосфору(V).

Слайд #21
Оксид фосфору (V) Р205 — білий дрібнокристалічний порошок, дуже гігроскопічний, тому застосовується для осушування газів.
Типовий кислотний оксид.
Енергійно реагує з водою, утворюючи різні фосфатні кислоти, залежно від співвідношення і температури води:
Р205 + Н20 = 2НР03
холодна метафосфатна кислота
Р205 + ЗН20 = 2Н3Р04
гаряча ортофосфатна
кислота
Типовий кислотний оксид.
Енергійно реагує з водою, утворюючи різні фосфатні кислоти, залежно від співвідношення і температури води:
Р205 + Н20 = 2НР03
холодна метафосфатна кислота
Р205 + ЗН20 = 2Н3Р04
гаряча ортофосфатна
кислота

Слайд #22
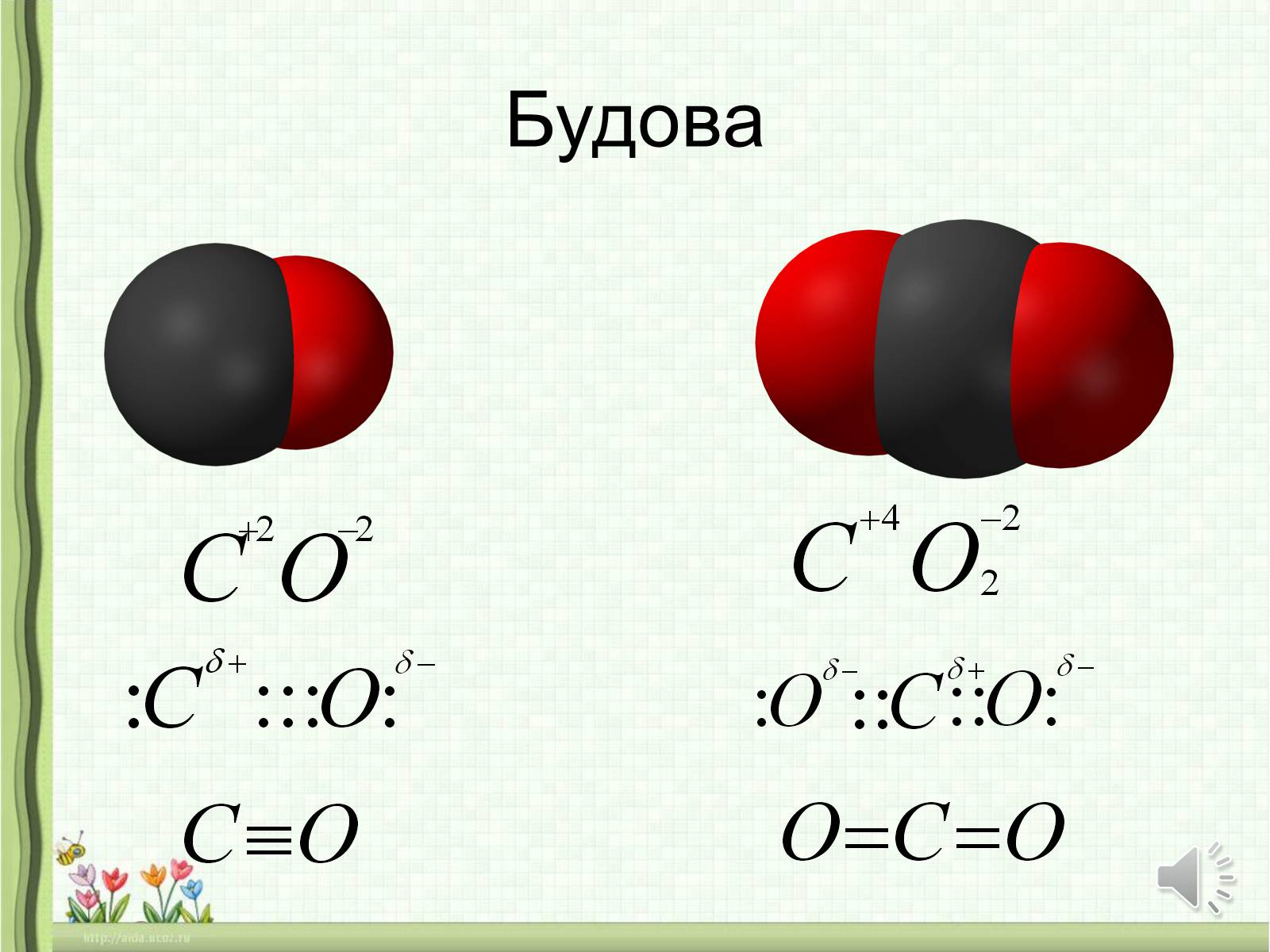
ЕЛЕМЕНТ КАРБОН З ЕЛЕМЕНТОМ ОКСИГЕНОМ утворює два оксиди —
С02 і СО.
С02 — оксид карбону(IV), діоксид карбону, вуглекислий газ;
СО — оксид карбону(II), монооксид карбону, чадний газ.
С02 і СО.
С02 — оксид карбону(IV), діоксид карбону, вуглекислий газ;
СО — оксид карбону(II), монооксид карбону, чадний газ.

Слайд #23
Будова
Слайд #24
Оксид карбону(IV), або вуглекислий газ, С02 за звичайних умов — безбарвний газ, без запаху, важчий за повітря в 1,5 раза, доволі добре розчиняється у воді, особливо під тиском, легко перетворюється на рідину навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений С02 зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого час-тина газу перетворюється на снігоподібну масу. Твердий вуглекислий газ називають сухим льодом.
Вуглекислий газ С02 у великих кількостях шкідливий для людіни і тварин
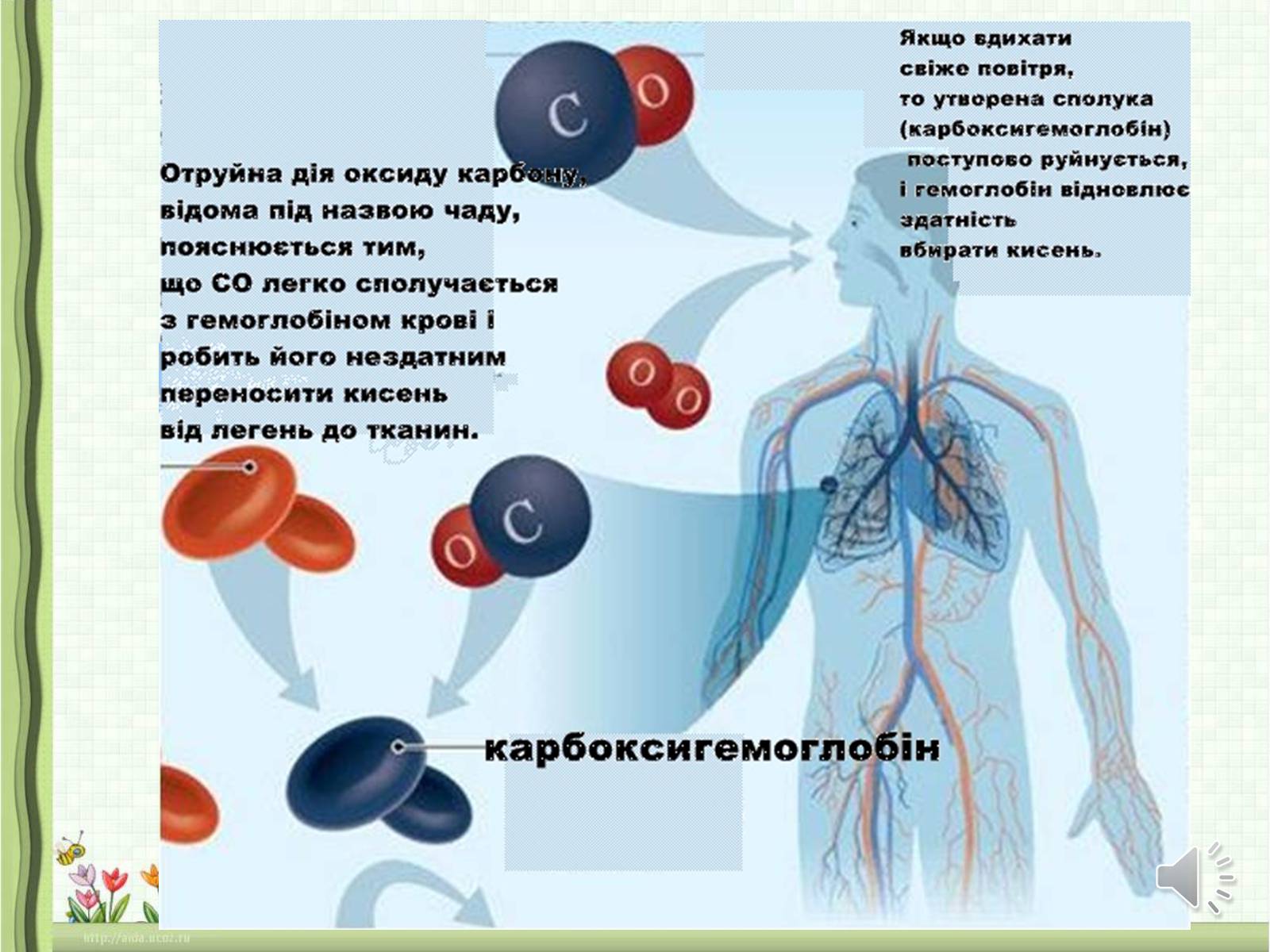
Оксид карбону СО, або чадний газ, — безбарвний, без запаху, погано розчиняється у воді, важко перетворюється на рідину (за нормального тиску і температури -191,5 °С), трохи легший за повітря. Чадний газ СО — дуже отруйний.
Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!
Вуглекислий газ С02 у великих кількостях шкідливий для людіни і тварин
Оксид карбону СО, або чадний газ, — безбарвний, без запаху, погано розчиняється у воді, важко перетворюється на рідину (за нормального тиску і температури -191,5 °С), трохи легший за повітря. Чадний газ СО — дуже отруйний.
Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!

Слайд #25
Оксид карбону(IV), або вуглекислий газ, С02 за звичайних умов — безбарвний газ, без запаху, важчий за повітря в 1,5 раза, доволі добре розчиняється у воді, особливо під тиском, легко перетворюється на рідину навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений С02 зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого час-тина газу перетворюється на снігоподібну масу. Твердий вуглекислий газ називають сухим льодом.
Вуглекислий газ С02 у великих кількостях шкідливий для людіни і тварин
Оксид карбону СО, або чадний газ, — безбарвний, без запаху, погано розчиняється у воді, важко перетворюється на рідину (за нормального тиску і температури -191,5 °С), трохи легший за повітря. Чадний газ СО — дуже отруйний.
Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!
Вуглекислий газ С02 у великих кількостях шкідливий для людіни і тварин
Оксид карбону СО, або чадний газ, — безбарвний, без запаху, погано розчиняється у воді, важко перетворюється на рідину (за нормального тиску і температури -191,5 °С), трохи легший за повітря. Чадний газ СО — дуже отруйний.
Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!
Слайд #26
Взаємодія з водою. Якщо у пробірку з водою (1 — 2 мл) додати 1—2 краплі розчину лакмусу, а потім пустити туди вуглекислий газ, лакмус змінить своє забарвлення, і розчин почервоніє.
Це пояснюється тим, що С02 взаємодіє з водою з утворенням нестійкої карбонатної кислоти:
H2O + CO2 ⇔ H2CO3
2. Взаємодія з основами і основними оксидами.
Оксид карбону (IV) С02 реагує з лугами у водних розчинах та з твердими лугами і основними оксидами за звичайних умов, утворюючи солі — карбонати:
Са(ОН)2 + С02 - СаС03↓ + Н20
СаО + С02 = СаС03
Оксид карбону(ІІ) CO як несолетвірний оксид зазначених вище реакцій не дає (солей не утворює). Йому притаманні інші властивості:
а) здатність горіти васильково-синім полум'ям, виділяючи велику кількість теплоти:
2СО + О = 2С02, ΔH = -572 кДж,
через що його використовують (разом з іншими газами) як газувате паливо (у доменному виробництві);
б) здатність відновлювати метали з оксидів (під час нагрівання):
Fe304 + 4СО = 3Fe + 4С02↑
Зазначена властивість використовується під час виплавляння металів із руд.
Це пояснюється тим, що С02 взаємодіє з водою з утворенням нестійкої карбонатної кислоти:
H2O + CO2 ⇔ H2CO3
2. Взаємодія з основами і основними оксидами.
Оксид карбону (IV) С02 реагує з лугами у водних розчинах та з твердими лугами і основними оксидами за звичайних умов, утворюючи солі — карбонати:
Са(ОН)2 + С02 - СаС03↓ + Н20
СаО + С02 = СаС03
Оксид карбону(ІІ) CO як несолетвірний оксид зазначених вище реакцій не дає (солей не утворює). Йому притаманні інші властивості:
а) здатність горіти васильково-синім полум'ям, виділяючи велику кількість теплоти:
2СО + О = 2С02, ΔH = -572 кДж,
через що його використовують (разом з іншими газами) як газувате паливо (у доменному виробництві);
б) здатність відновлювати метали з оксидів (під час нагрівання):
Fe304 + 4СО = 3Fe + 4С02↑
Зазначена властивість використовується під час виплавляння металів із руд.

Слайд #27
Добування оксиду карбону(ІУ). У лабораторних умовах С02 добувають дією хлоридної кислоти на мармур:
СаС03 + 2НСl = СаСl2 + Н20 + С02↑
У промисловості оксид карбону(ІV) добувають прожарюванням вапняку:
СаС03 = СаО + С02↑
Застосування. Вуглекислий газ С02 застосовують під час виробництва соди, цукру, для газування води, гасіння пожеж (наприклад, содові вогнегасники). Сухий лід використовують для зберігання продуктів, які швидко псуються.
СаС03 + 2НСl = СаСl2 + Н20 + С02↑
У промисловості оксид карбону(ІV) добувають прожарюванням вапняку:
СаС03 = СаО + С02↑
Застосування. Вуглекислий газ С02 застосовують під час виробництва соди, цукру, для газування води, гасіння пожеж (наприклад, содові вогнегасники). Сухий лід використовують для зберігання продуктів, які швидко псуються.

Слайд #28
Застосовується діоксид карбону у виробництві соди за аміачно-хлоридним способом ,
для синтезу карбаміду,
добування солей карбонатної кислоти,
а також газування фруктових і мінеральних вод та інших напоїв.
Добавляння вуглекислого газу в повітря теплиць прискорює ріст і достигання ранніх овочів.
для синтезу карбаміду,
добування солей карбонатної кислоти,
а також газування фруктових і мінеральних вод та інших напоїв.
Добавляння вуглекислого газу в повітря теплиць прискорює ріст і достигання ранніх овочів.

Слайд #29
Застосовується діоксид карбону у виробництві соди за аміачно-хлоридним способом ,
для синтезу карбаміду,
добування солей карбонатної кислоти,
а також газування фруктових і мінеральних вод та інших напоїв.
Добавляння вуглекислого газу в повітря теплиць прискорює ріст і достигання ранніх овочів.
для синтезу карбаміду,
добування солей карбонатної кислоти,
а також газування фруктових і мінеральних вод та інших напоїв.
Добавляння вуглекислого газу в повітря теплиць прискорює ріст і достигання ранніх овочів.
Слайд #30
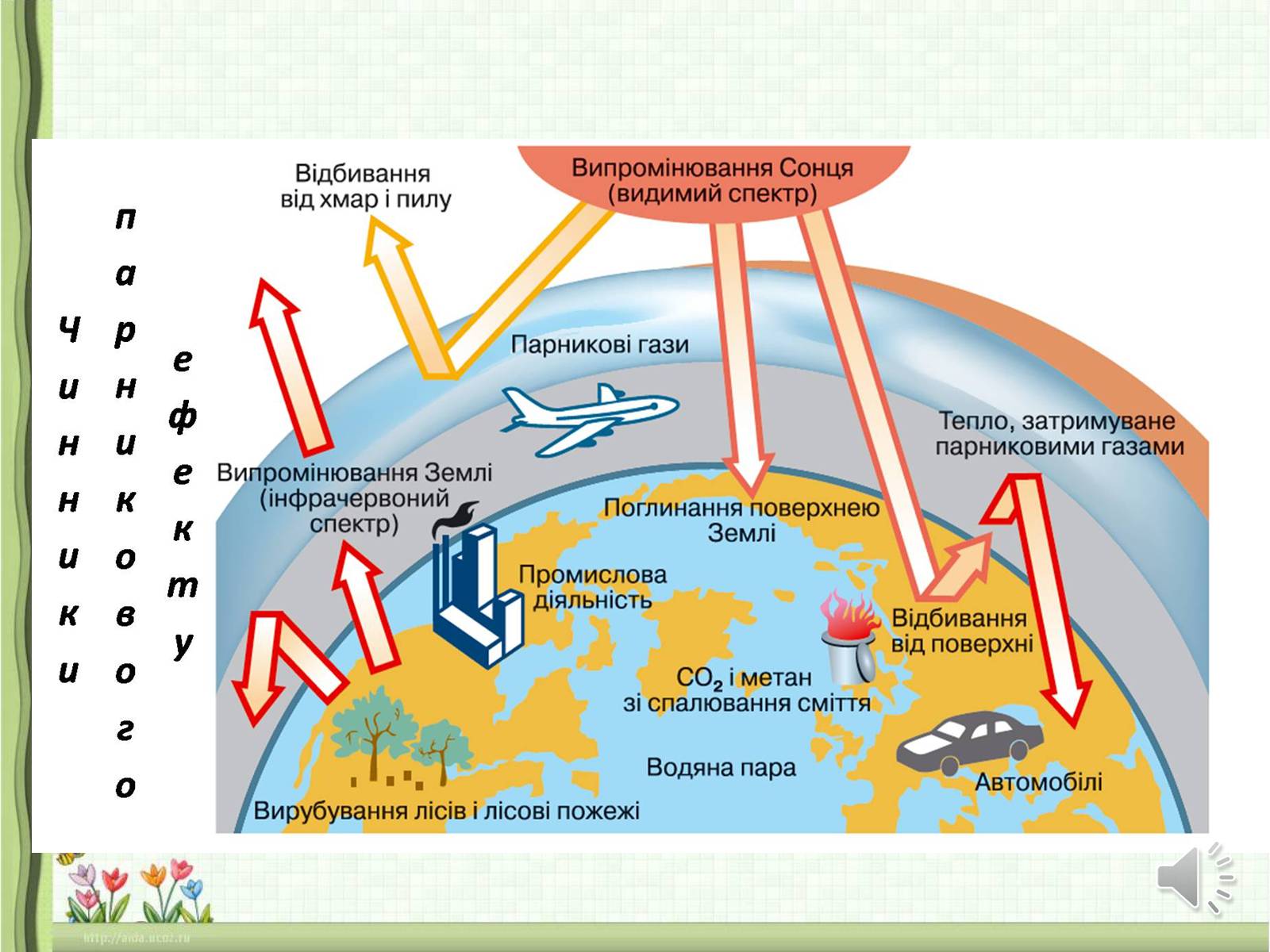
Наслідки парникового ефекту

Слайд #31
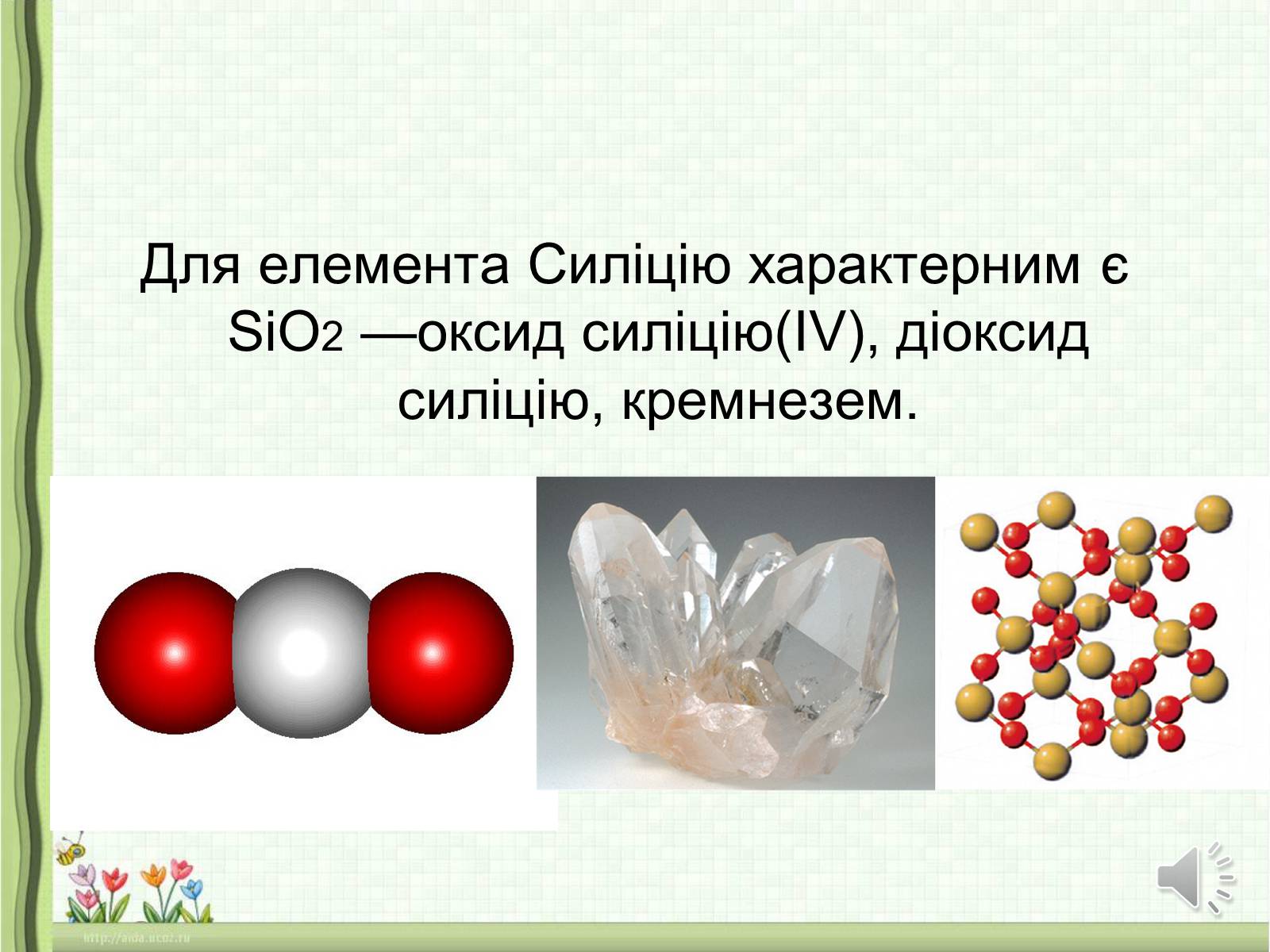
Для елемента Силіцію характерним є SiO2 —оксид силіцію(IV), діоксид силіцію, кремнезем.
Слайд #32
Оксид силіцію(ІV) SiO2, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (tпл. 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок).

Слайд #33
Оксид силіцію(ІV) SiO2, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (tпл. 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок).
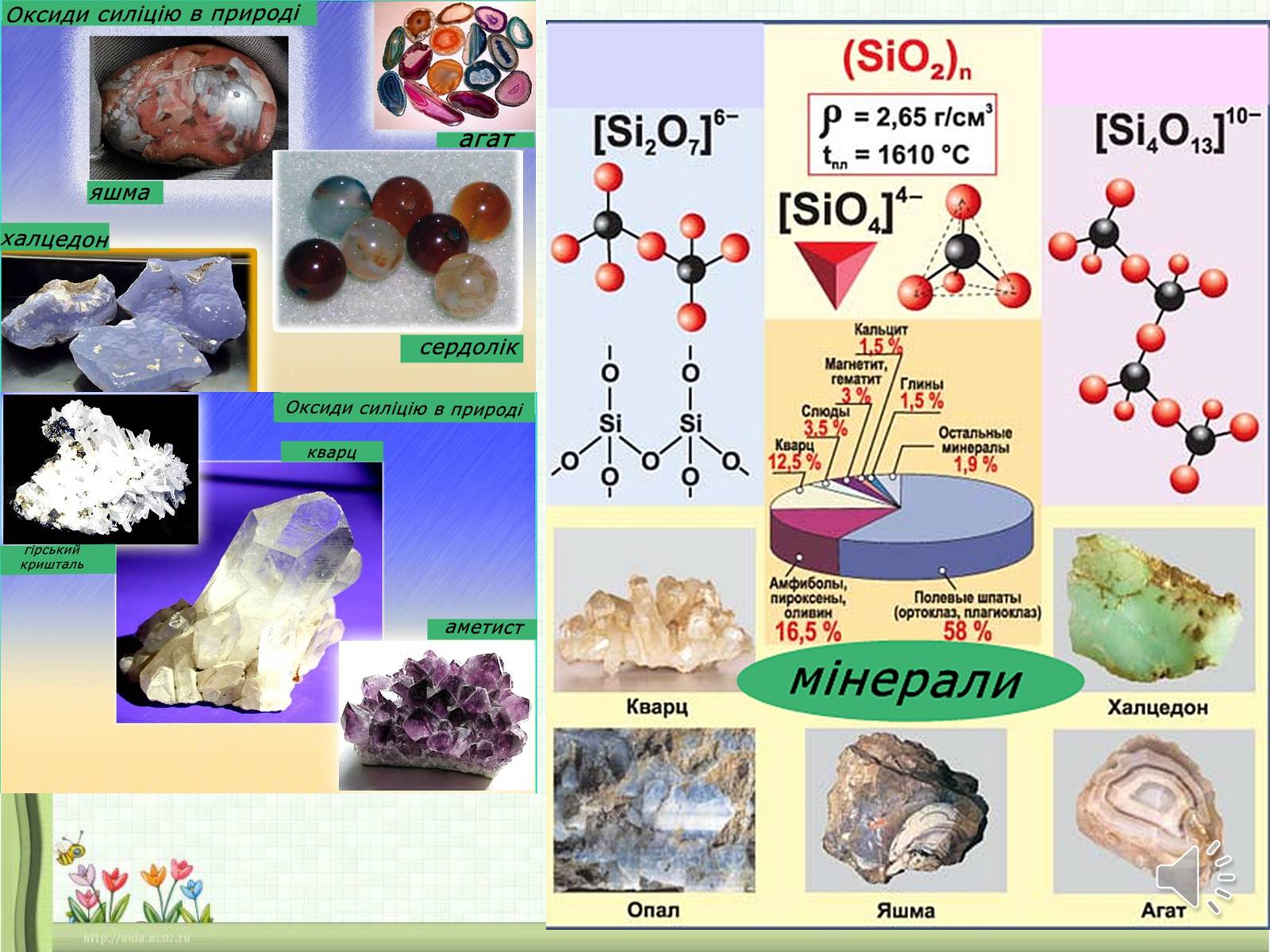
Слайд #34
Оксид силіцію (IV) Si02 взаємодіє з твердими лугами та основними оксидами під час сплавляння, утворюючи солі — силікати:
2NaOH + Si02 = Na2Si03 + Н20
BaO + Si02 = BaSi03
Діоксид силіцію SiO2 у вигляді піску широко застосовують у будівництві, для добування скла, кераміки, порцеляни, фаянсу, цегли, цементу, абразивів. У вигляді кварцу Sі02 використовують у радіотехніці, в акустоелектроніці, в оптичному приладобудуванні. Синтетичний діоксид силіцію Sі02 («біла сажа») застосовується як наповнювач у виробництві гуми.
2NaOH + Si02 = Na2Si03 + Н20
BaO + Si02 = BaSi03
Діоксид силіцію SiO2 у вигляді піску широко застосовують у будівництві, для добування скла, кераміки, порцеляни, фаянсу, цегли, цементу, абразивів. У вигляді кварцу Sі02 використовують у радіотехніці, в акустоелектроніці, в оптичному приладобудуванні. Синтетичний діоксид силіцію Sі02 («біла сажа») застосовується як наповнювач у виробництві гуми.

Слайд #35
Зважаючи на те, що солетвірні оксиди неметалічних елементів належать до кислотних оксидів, їх гідратними формами є оксигеновмісні кислоти
Більшість із них одержують під час прямої взаємодії відповідного оксиду з водою.
Більшість із них одержують під час прямої взаємодії відповідного оксиду з водою.

Слайд #36
Домашне завдання
