- Головна
- Готові шкільні презентації
- Презентація на тему «Метали» (варіант 3)
Презентація на тему «Метали» (варіант 3)
230
Слайд #1
Підготував: учень 10-Б
Резніков Дмитрій
Метали
Резніков Дмитрій
Метали

Слайд #2
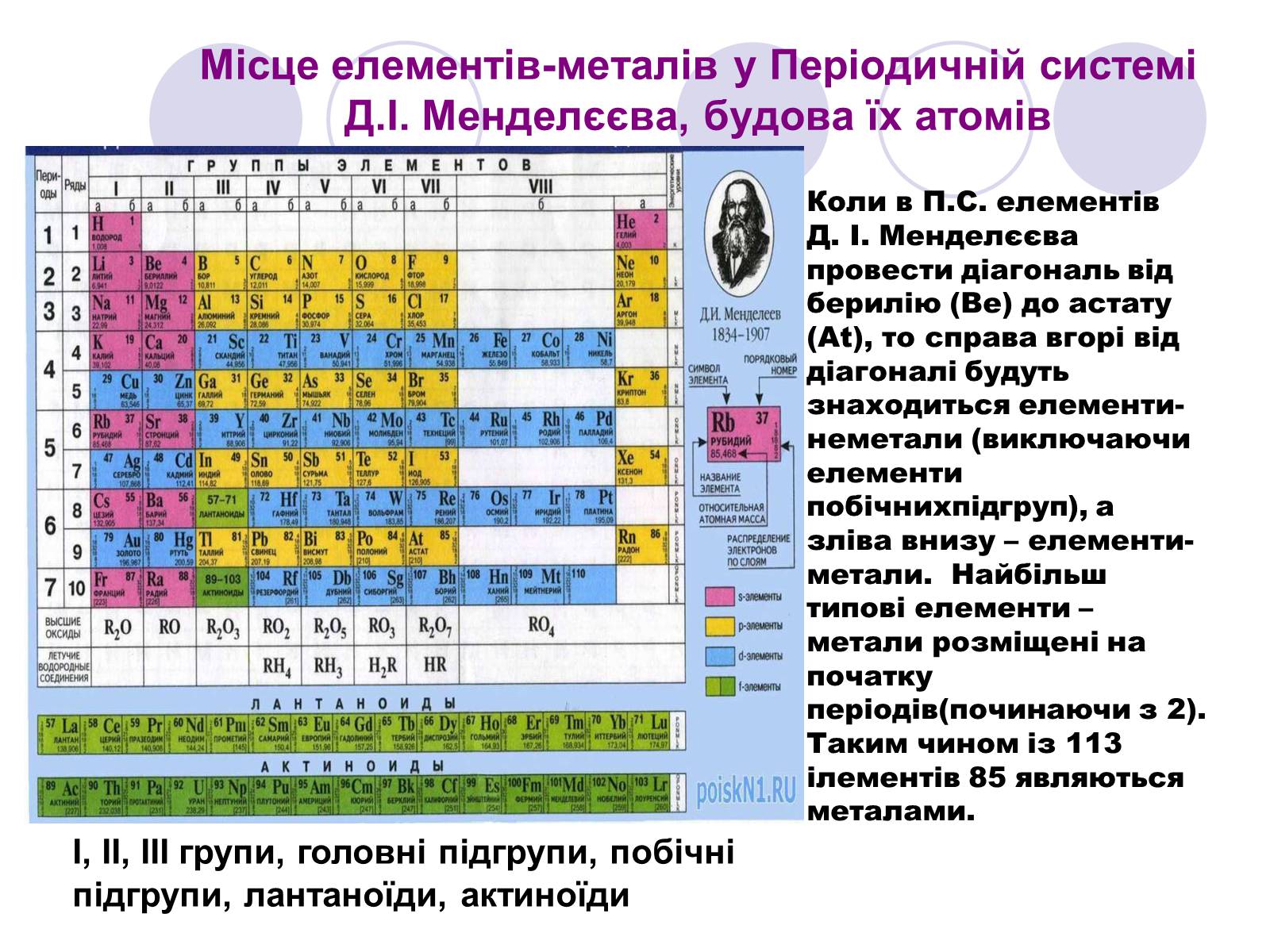
Місце елементів-металів у Періодичній системі Д.І. Менделєєва, будова їх атомів
І, ІІ, ІІІ групи, головні підгрупи, побічні підгрупи, лантаноїди, актиноїди
Коли в П.С. елементів Д. І. Менделєєва провести діагональ від берилію (Be) до астату (At), то справа вгорі від діагоналі будуть знаходиться елементи-неметали (виключаючи елементи побічнихпідгруп), а зліва внизу – елементи-метали. Найбільш типові елементи – метали розміщені на початку періодів(починаючи з 2). Таким чином із 113 ілементів 85 являються металами.
І, ІІ, ІІІ групи, головні підгрупи, побічні підгрупи, лантаноїди, актиноїди
Коли в П.С. елементів Д. І. Менделєєва провести діагональ від берилію (Be) до астату (At), то справа вгорі від діагоналі будуть знаходиться елементи-неметали (виключаючи елементи побічнихпідгруп), а зліва внизу – елементи-метали. Найбільш типові елементи – метали розміщені на початку періодів(починаючи з 2). Таким чином із 113 ілементів 85 являються металами.
Слайд #3
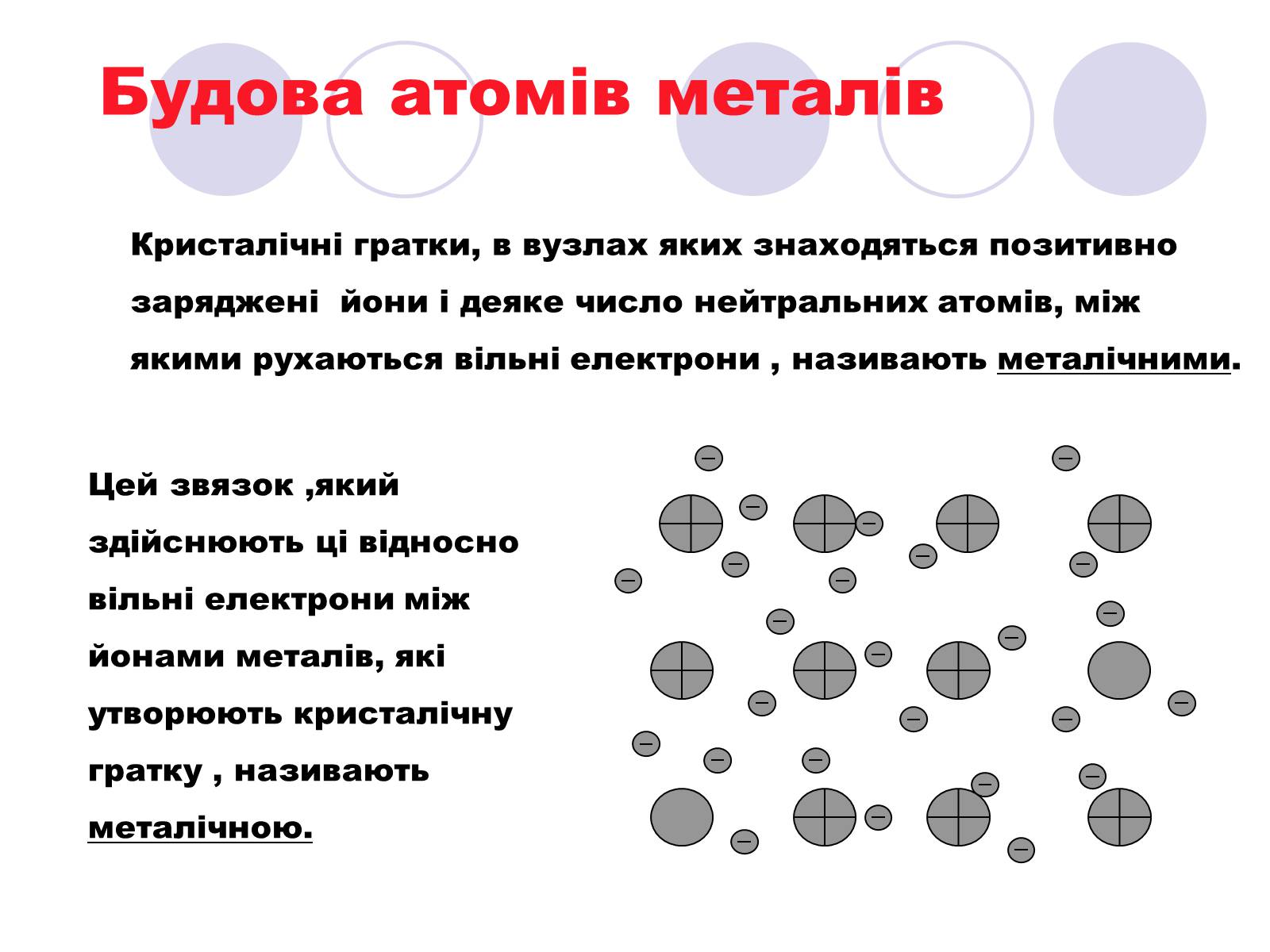
Будова атомів металів
Кристалічні гратки, в вузлах яких знаходяться позитивно заряджені йони і деяке число нейтральних атомів, між якими рухаються вільні електрони , називають металічними.
Цей звязок ,який здійснюють ці відносно вільні електрони між йонами металів, які утворюють кристалічну гратку , називають металічною.
Кристалічні гратки, в вузлах яких знаходяться позитивно заряджені йони і деяке число нейтральних атомів, між якими рухаються вільні електрони , називають металічними.
Цей звязок ,який здійснюють ці відносно вільні електрони між йонами металів, які утворюють кристалічну гратку , називають металічною.
Слайд #4
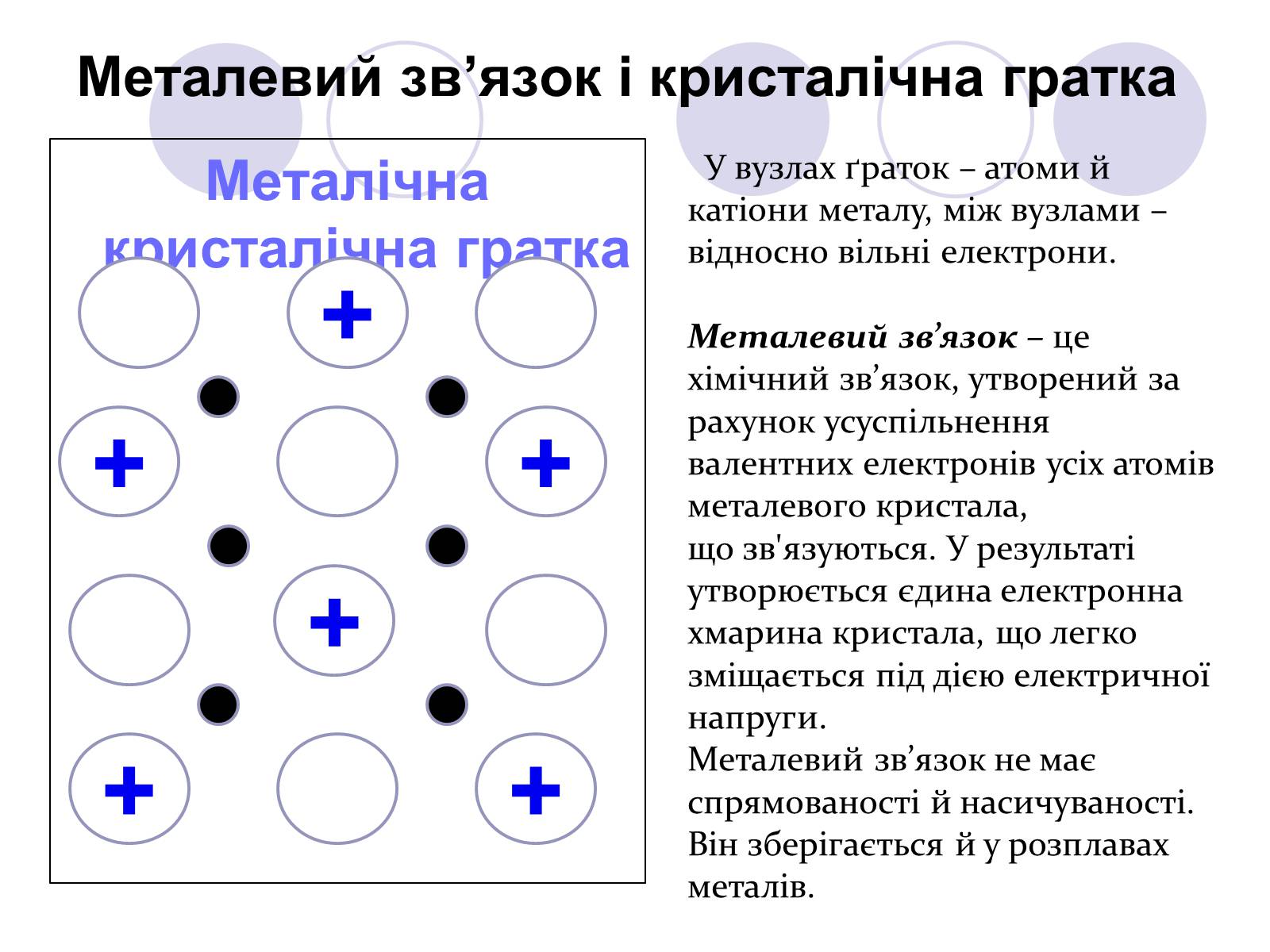
Металічна кристалічна гратка
Металевий зв'язок і кристалічна гратка
+
+
+
+
У вузлах ґраток – атоми й
катіони металу, між вузлами –
відносно вільні електрони.
Металевий зв'язок – це хімічний зв'язок, утворений за рахунок усуспільнення валентних електронів усіх атомів металевого кристала,
що зв'язуються. У результаті утворюється єдина електронна хмарина кристала, що легко зміщається під дією електричної напруги.
Металевий зв'язок не має спрямованості й насичуваності. Він зберігається й у розплавах металів.
+
+
Металевий зв'язок і кристалічна гратка
+
+
+
+
У вузлах ґраток – атоми й
катіони металу, між вузлами –
відносно вільні електрони.
Металевий зв'язок – це хімічний зв'язок, утворений за рахунок усуспільнення валентних електронів усіх атомів металевого кристала,
що зв'язуються. У результаті утворюється єдина електронна хмарина кристала, що легко зміщається під дією електричної напруги.
Металевий зв'язок не має спрямованості й насичуваності. Він зберігається й у розплавах металів.
+
+
Слайд #5
Фізичні властивості
температура плавлення
Ме
металічний блиск
теплопровідность
електропровідность
температура кипіння
твердість
густина
металічний дзвін
температура плавлення
Ме
металічний блиск
теплопровідность
електропровідность
температура кипіння
твердість
густина
металічний дзвін
Слайд #6
1) Для всіх металів характерний металічний блиск, сірий колір і непрозорість пояснюються наявністю вільних електронів .
2) Метали володіють електричною провідністю, це пояснюються наявністю вільних електронів. Найбільшою електричною провідністю володіють срібло і мідь. За ними - золото, алюміній, залізо.
Фізичні властивості
Електричний струм– це напрямлений рух заряджених частинок.
2) Метали володіють електричною провідністю, це пояснюються наявністю вільних електронів. Найбільшою електричною провідністю володіють срібло і мідь. За ними - золото, алюміній, залізо.
Фізичні властивості
Електричний струм– це напрямлений рух заряджених частинок.

Слайд #7
1) Для всіх металів характерний металічний блиск, сірий колір і непрозорість пояснюються наявністю вільних електронів .
2) Метали володіють електричною провідністю, це пояснюються наявністю вільних електронів. Найбільшою електричною провідністю володіють срібло і мідь. За ними - золото, алюміній, залізо.
Фізичні властивості
Електричний струм– це напрямлений рух заряджених частинок.
2) Метали володіють електричною провідністю, це пояснюються наявністю вільних електронів. Найбільшою електричною провідністю володіють срібло і мідь. За ними - золото, алюміній, залізо.
Фізичні властивості
Електричний струм– це напрямлений рух заряджених частинок.

Слайд #8
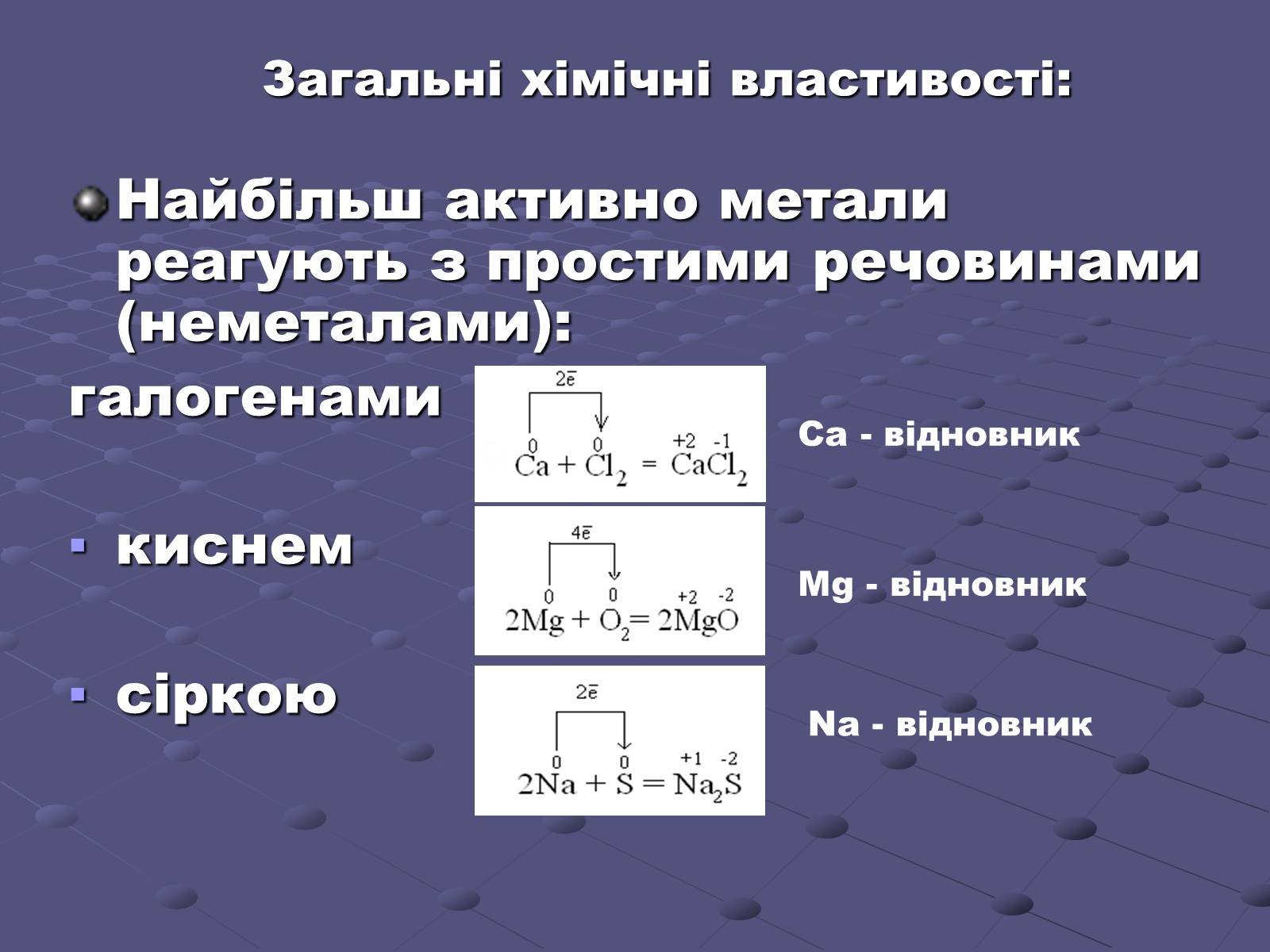
Загальні хімічні властивості:
Найбільш активно метали реагують з простими речовинами (неметалами):
галогенами
киснем
сіркою
Ca - відновник
Mg - відновник
Na - відновник
Найбільш активно метали реагують з простими речовинами (неметалами):
галогенами
киснем
сіркою
Ca - відновник
Mg - відновник
Na - відновник
Слайд #9
Метали, гідроксиди яких амфотерні, як правило взаємодіють з розчинами кислот і лугів.
Основна властивість металів – вони відновники.
Метали можуть утворювати хімічні сполуки між собою.Вони мають загальну назву – інтерметалічні сполуки або інтерметаліди.
Прикладом є сполуки деяких металів з сурмою: Na2Sb, Ca3Sb, NiSb, Ni4Sb, FeSbx (х = 0,72 – 0,92). В них найчастіше всього не зберігаються ступені окиснення, характерні в сполуках з неметалами.
Загальні хімічні властивості .
Основна властивість металів – вони відновники.
Метали можуть утворювати хімічні сполуки між собою.Вони мають загальну назву – інтерметалічні сполуки або інтерметаліди.
Прикладом є сполуки деяких металів з сурмою: Na2Sb, Ca3Sb, NiSb, Ni4Sb, FeSbx (х = 0,72 – 0,92). В них найчастіше всього не зберігаються ступені окиснення, характерні в сполуках з неметалами.
Загальні хімічні властивості .

Слайд #10
Загальні хімічні властивості (продовження)
Метали можуть окиснюватися також йонами Гідрогену та йонами інших металів.
Метали реагують з складними речовинами :
водою:
кислотами:
растворами солей:
Na - відновник
Fe - відновник
Zn - відновник
Метали можуть окиснюватися також йонами Гідрогену та йонами інших металів.
Метали реагують з складними речовинами :
водою:
кислотами:
растворами солей:
Na - відновник
Fe - відновник
Zn - відновник

Слайд #11
Взаємодія лужного металу з водою
2Na + 2H2O = 2NaOH + H2
Активні метали, що стоять у ряду стандартних електродних потенціалів до Алюмінію включно, реагують із водою з утворенням основ і водню
2Na + 2H2O = 2NaOH + H2
Активні метали, що стоять у ряду стандартних електродних потенціалів до Алюмінію включно, реагують із водою з утворенням основ і водню

Слайд #12
Взаємодія лужно-земельного металу з водою
Са + 2Н2О = Са(ОН)2 + H2
Са + 2Н2О = Са(ОН)2 + H2

Слайд #13
Горіння магнію
0 0 +2 -2
2Мg + O2 = 2MgO
0 0 +2 -2
2Мg + O2 = 2MgO

Слайд #14
Реакція горіння кальцію в повітрі(реакція протікає бурхливо)
2Ca + O₂ = 2CaO
2Ca + O₂ = 2CaO

Слайд #15
Реакція горіння літію
Li + O₂ = Li₂O
Li + O₂ = Li₂O

Слайд #16
Каталітична реакція взаємодії алюмінію з йодом
4Al + 3I2 2AlI3
4Al + 3I2 2AlI3

Слайд #17
Електрохімічний ряд напруг
Цей ряд називається електрохімічним рядом напруг.
Енергія іонізаціі, визначається положенням металу в періодичній системі. В електрохімічному ряду напруг метал, який стоїть лівіше, може витіснити із розчину або розплаву солей метал, який стоїть правіше.Користуючись цим рядом, можно передбачити, як Ме буде себя вести в парі з іншим .
В електрохімічному ряді напруг розміщений Гідроген .Це
дозволяє зробити висновок про Ме ,які можуть витіснити водень із розчинів кислот. Так , наприклад, залізо витісняє водень із розчинів кислот, так как знаходиться лівіше нього; мідь же не витісняє водень, так как знаходиться правіше нього.
послаблення відновних властивостей, активності
Цей ряд називається електрохімічним рядом напруг.
Енергія іонізаціі, визначається положенням металу в періодичній системі. В електрохімічному ряду напруг метал, який стоїть лівіше, може витіснити із розчину або розплаву солей метал, який стоїть правіше.Користуючись цим рядом, можно передбачити, як Ме буде себя вести в парі з іншим .
В електрохімічному ряді напруг розміщений Гідроген .Це
дозволяє зробити висновок про Ме ,які можуть витіснити водень із розчинів кислот. Так , наприклад, залізо витісняє водень із розчинів кислот, так как знаходиться лівіше нього; мідь же не витісняє водень, так как знаходиться правіше нього.
послаблення відновних властивостей, активності

Слайд #18
Корозія металів
Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища.
Існує два види корозії: хімічна і електрохімічна .
Електрохімічна корозія
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.
Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища.
Існує два види корозії: хімічна і електрохімічна .
Електрохімічна корозія
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.

Слайд #19
Корозія металів
Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища.
Існує два види корозії: хімічна і електрохімічна .
Електрохімічна корозія
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.
Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища.
Існує два види корозії: хімічна і електрохімічна .
Електрохімічна корозія
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.

Слайд #20
Корозія металів
Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища.
Існує два види корозії: хімічна і електрохімічна .
Електрохімічна корозія
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.
Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища.
Існує два види корозії: хімічна і електрохімічна .
Електрохімічна корозія
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.

Слайд #21
Корозія металів
Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища.
Існує два види корозії: хімічна і електрохімічна .
Електрохімічна корозія
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.
Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища.
Існує два види корозії: хімічна і електрохімічна .
Електрохімічна корозія
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.

Слайд #22
Корозія металів
Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища.
Існує два види корозії: хімічна і електрохімічна .
Електрохімічна корозія
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.
Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища.
Існує два види корозії: хімічна і електрохімічна .
Електрохімічна корозія
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.

Слайд #23
Царь – пушка (бронза)

Слайд #24
Царь-дзвін (бронза)

Слайд #25
Царь-дзвін (бронза)

Слайд #26
Царь-дзвін (бронза)

Слайд #27
Царь-дзвін (бронза)

Слайд #28
Царь-дзвін (бронза)
Слайд #29
Царь-дзвін (бронза)

Слайд #30
Цікаві відомості про ЗОЛОТО:
Температура плавлення золота дорівнює 1064,43 градуси за Цельсієм. Цей метал відмінно проводить тепло і електрика, ніколи не іржавіє.
Золото - один із самих коштовних металів. Висока вартість золота стала підмогою для активного розвитку копалень у різних куточках планети. Тим не менше, вважається, що 80% загальних запасів дорогоцінного металу до цих пір знаходяться в надрах Землі.
Золото - дуже гнучкий метал. З нього можна виготовляти швейні нитки. Одна унцій золота (28,35 грама) може бути розтягнута на 80 кілометрів.
одного з найбільших золотих самородків дорівнював 72 кг, його розміри становили - 31 × 63,5 см.
Золото - хімічно інертна речовина, тому воно ніколи не іржавіє і не викликає подразнення шкіри. Якщо ювелірний виріб із золота викликало алергічну реакцію, значить, в сплав доданий інший метал.
Медалі для переможців олімпійських ігор були відлиті з золота цілком. У сучасних медалях золотом покривається лише «зовнішня оболонка». На це витрачається 6 грамів дорогоцінного металу.
Вага золота в каратах може становити 10, 12, 14, 18, 22 або 24. Чим більше цей показник, тим вище якість золота. «Чисте золото» вважається з мінімальною вагою в 10 карат. «Найчистіше золото» - 24 карата, однак і в ньому міститься невелика кількість міді. Чисте золото настільки м'яке і пластичне, що його можна формувати вручну.
Температура плавлення золота дорівнює 1064,43 градуси за Цельсієм. Цей метал відмінно проводить тепло і електрика, ніколи не іржавіє.
Золото - один із самих коштовних металів. Висока вартість золота стала підмогою для активного розвитку копалень у різних куточках планети. Тим не менше, вважається, що 80% загальних запасів дорогоцінного металу до цих пір знаходяться в надрах Землі.
Золото - дуже гнучкий метал. З нього можна виготовляти швейні нитки. Одна унцій золота (28,35 грама) може бути розтягнута на 80 кілометрів.
одного з найбільших золотих самородків дорівнював 72 кг, його розміри становили - 31 × 63,5 см.
Золото - хімічно інертна речовина, тому воно ніколи не іржавіє і не викликає подразнення шкіри. Якщо ювелірний виріб із золота викликало алергічну реакцію, значить, в сплав доданий інший метал.
Медалі для переможців олімпійських ігор були відлиті з золота цілком. У сучасних медалях золотом покривається лише «зовнішня оболонка». На це витрачається 6 грамів дорогоцінного металу.
Вага золота в каратах може становити 10, 12, 14, 18, 22 або 24. Чим більше цей показник, тим вище якість золота. «Чисте золото» вважається з мінімальною вагою в 10 карат. «Найчистіше золото» - 24 карата, однак і в ньому міститься невелика кількість міді. Чисте золото настільки м'яке і пластичне, що його можна формувати вручну.
