- Головна
- Готові шкільні презентації
- Презентація на тему «Хімічні реакції»
Презентація на тему «Хімічні реакції»
309
Слайд #1
1
Хімічні реакції
Урок в 9 класі
КЗ Верхівцевського НВК
Учитель Кукса Н.М
Хімічні реакції
Урок в 9 класі
КЗ Верхівцевського НВК
Учитель Кукса Н.М

Слайд #2
Мета
Дати визначення типів хімічних реакцій;
Навчити визначати тип реакцій за ознаками;
Дати поняття окисно-відновних реакцій та теплового ефекту реакції
2
Дати визначення типів хімічних реакцій;
Навчити визначати тип реакцій за ознаками;
Дати поняття окисно-відновних реакцій та теплового ефекту реакції
2

Слайд #3
Цілі:
Класифікація хімічних реакцій;
Енергетичний ефект хімічних реакцій;
Окисно-відновні реакції;
Швидкість хімічних реакцій;
Хімічна рівновага
3
Класифікація хімічних реакцій;
Енергетичний ефект хімічних реакцій;
Окисно-відновні реакції;
Швидкість хімічних реакцій;
Хімічна рівновага
3

Слайд #4
4
Хімічне рівняння -
це умовне зображення реакції
за допомогою хімічних формул
і, в разі потреби, коефіцієнтів
Н Н
ОО + Н Н = Н О Н Н О Н
О2+2Н2=2Н2О
Хімічні рівняння
Хімічне рівняння -
це умовне зображення реакції
за допомогою хімічних формул
і, в разі потреби, коефіцієнтів
Н Н
ОО + Н Н = Н О Н Н О Н
О2+2Н2=2Н2О
Хімічні рівняння

Слайд #5
5
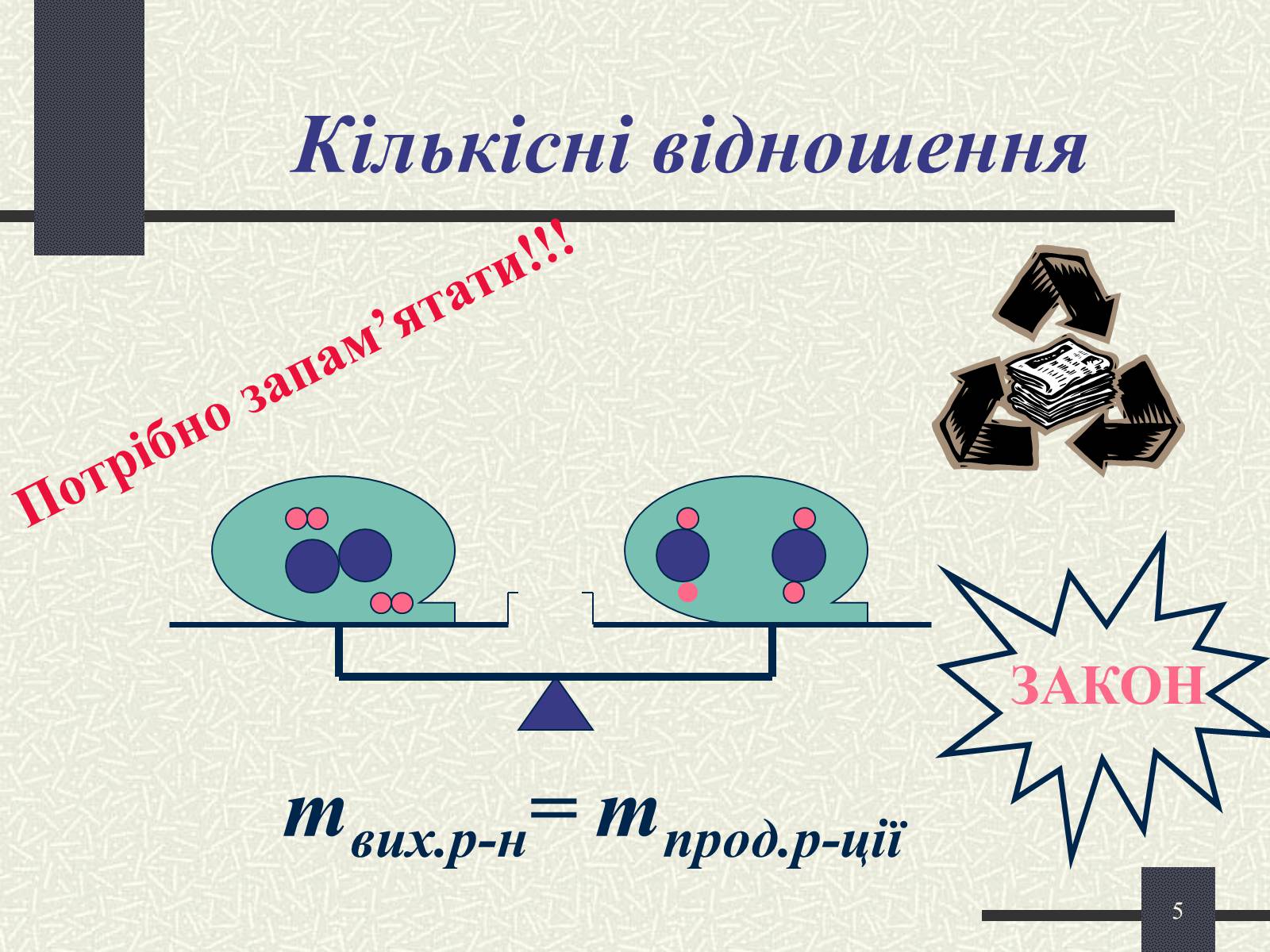
mвих.р-н= mпрод.р-ції
ЗАКОН
Кількісні відношення
Потрібно запам'ятати!!!
mвих.р-н= mпрод.р-ції
ЗАКОН
Кількісні відношення
Потрібно запам'ятати!!!
Слайд #6
6
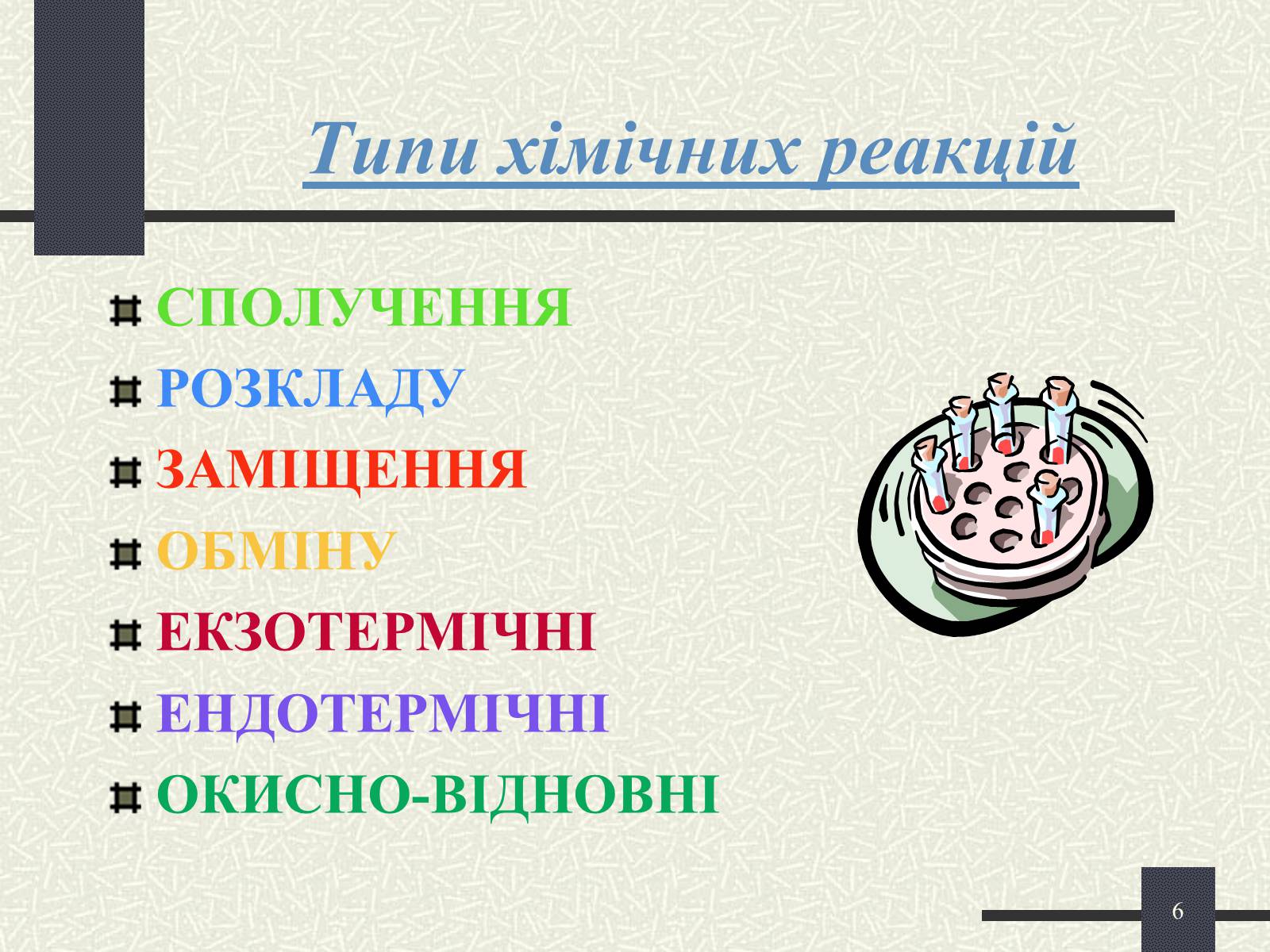
Типи хімічних реакцій
СПОЛУЧЕННЯ
РОЗКЛАДУ
ЗАМІЩЕННЯ
ОБМІНУ
ЕКЗОТЕРМІЧНІ
ЕНДОТЕРМІЧНІ
ОКИСНО-ВІДНОВНІ
Типи хімічних реакцій
СПОЛУЧЕННЯ
РОЗКЛАДУ
ЗАМІЩЕННЯ
ОБМІНУ
ЕКЗОТЕРМІЧНІ
ЕНДОТЕРМІЧНІ
ОКИСНО-ВІДНОВНІ
Слайд #7
7

Слайд #8
8
Реакції сполучення
ПРИКЛАДИ:
3Fe + 2O2 = Fe3O4 BaО + H2O = Ba(OH)2
2Al + 3Br2 = 2AlBr3 CaO + SiO2 = CaSiO3
ЗАВДАННЯ 1:
Записати рівняння реакції і назвати продукти:
? + H2O KOH + ?
CAO + ? Ca(OH)2
MgO + ? MgCl2 + ?
Реакції сполучення
ПРИКЛАДИ:
3Fe + 2O2 = Fe3O4 BaО + H2O = Ba(OH)2
2Al + 3Br2 = 2AlBr3 CaO + SiO2 = CaSiO3
ЗАВДАННЯ 1:
Записати рівняння реакції і назвати продукти:
? + H2O KOH + ?
CAO + ? Ca(OH)2
MgO + ? MgCl2 + ?

Слайд #9
9
Реакції розкладу
ПРИКЛАДИ:
2KClO3 = 2KCl + 3O2
2KMnO4 = K2MnO4 + MnO2 + O2
2H2O2 = 2H2O + O2
ЗАВДАННЯ 2:
В якому рівнянні невірно розставлені коефіцієнти?
CaCO3 = CaO + CO2
2NH3 =N2 + 2H2
Cu(OH)2 =t CuO + H2O
NH4Cl = NH3 + 2HCL
Реакції розкладу
ПРИКЛАДИ:
2KClO3 = 2KCl + 3O2
2KMnO4 = K2MnO4 + MnO2 + O2
2H2O2 = 2H2O + O2
ЗАВДАННЯ 2:
В якому рівнянні невірно розставлені коефіцієнти?
CaCO3 = CaO + CO2
2NH3 =N2 + 2H2
Cu(OH)2 =t CuO + H2O
NH4Cl = NH3 + 2HCL

Слайд #10
10
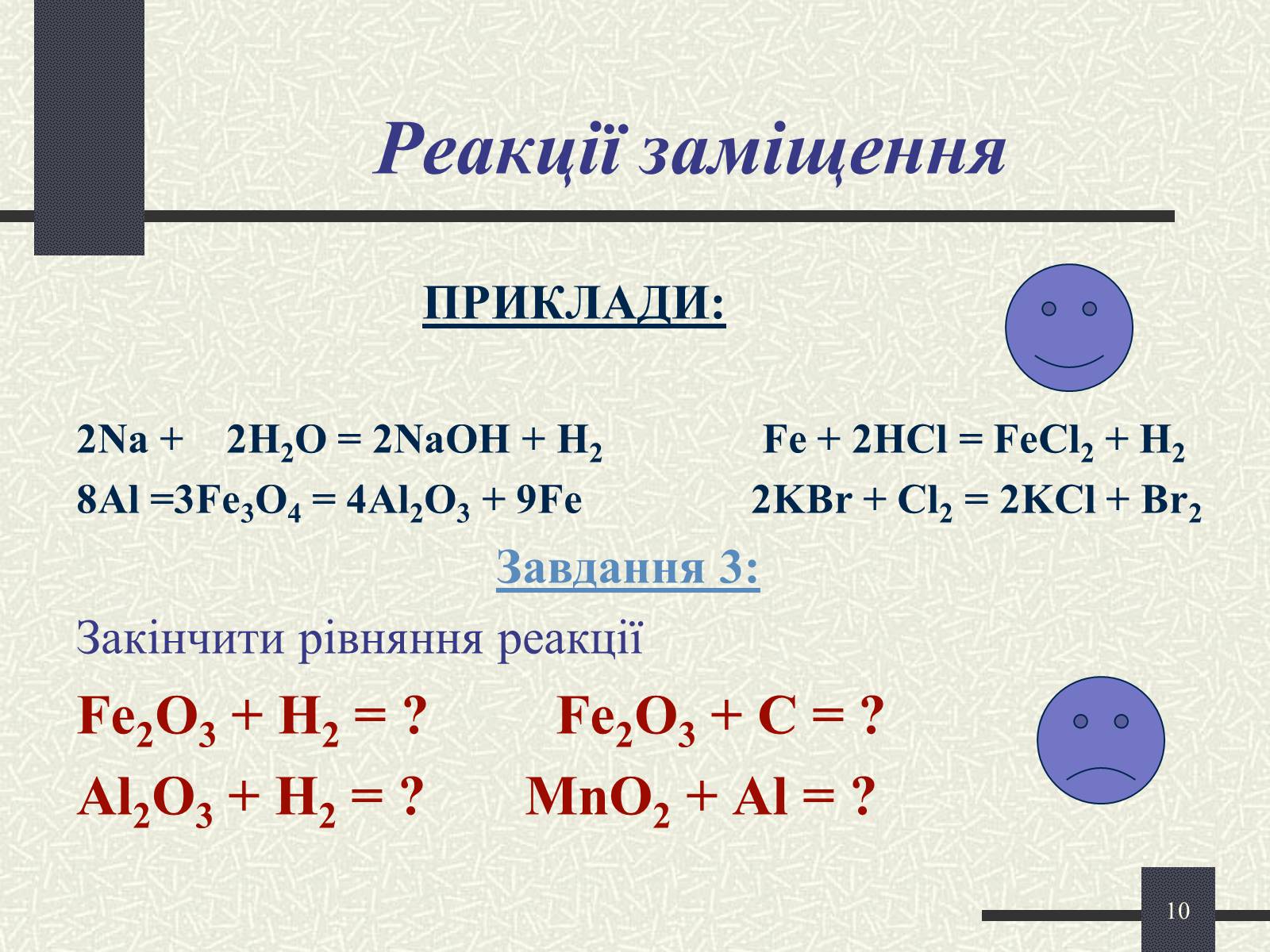
Реакції заміщення
ПРИКЛАДИ:
2Na + 2H2O = 2NaOH + H2 Fe + 2HCl = FeCl2 + H2
8Al =3Fe3O4 = 4Al2O3 + 9Fe 2KBr + Cl2 = 2KCl + Br2
Завдання 3:
Закінчити рівняння реакції
Fe2O3 + H2 = ? Fe2O3 + C = ?
Al2O3 + H2 = ? MnO2 + Al = ?
Реакції заміщення
ПРИКЛАДИ:
2Na + 2H2O = 2NaOH + H2 Fe + 2HCl = FeCl2 + H2
8Al =3Fe3O4 = 4Al2O3 + 9Fe 2KBr + Cl2 = 2KCl + Br2
Завдання 3:
Закінчити рівняння реакції
Fe2O3 + H2 = ? Fe2O3 + C = ?
Al2O3 + H2 = ? MnO2 + Al = ?
Слайд #11
11
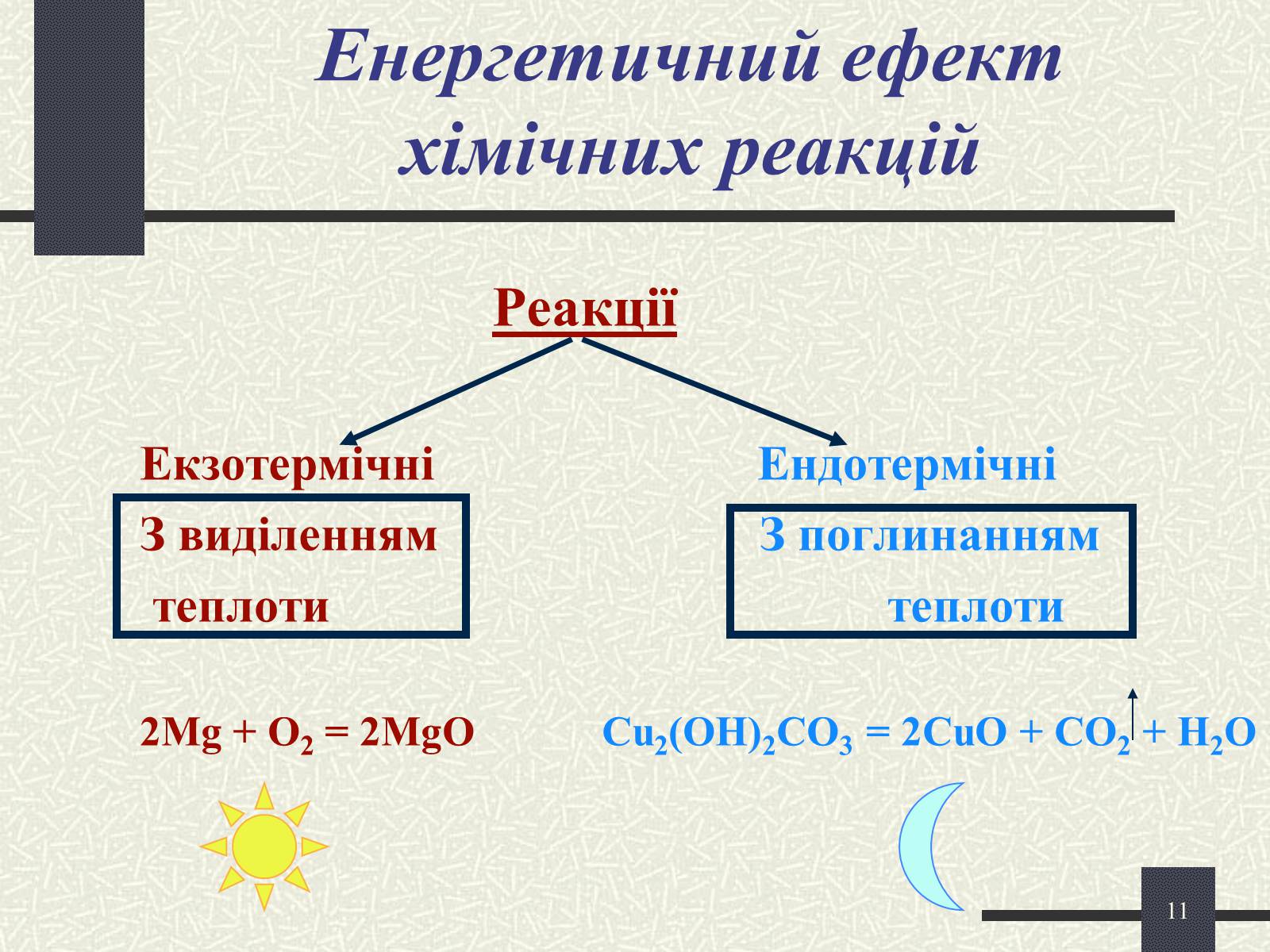
Енергетичний ефект хімічних реакцій
Реакції
Екзотермічні Ендотермічні
З виділенням З поглинанням
теплоти теплоти
2Mg + O2 = 2MgO Cu2(OH)2CO3 = 2CuO + CO2 + H2O
Енергетичний ефект хімічних реакцій
Реакції
Екзотермічні Ендотермічні
З виділенням З поглинанням
теплоти теплоти
2Mg + O2 = 2MgO Cu2(OH)2CO3 = 2CuO + CO2 + H2O
Слайд #12
12
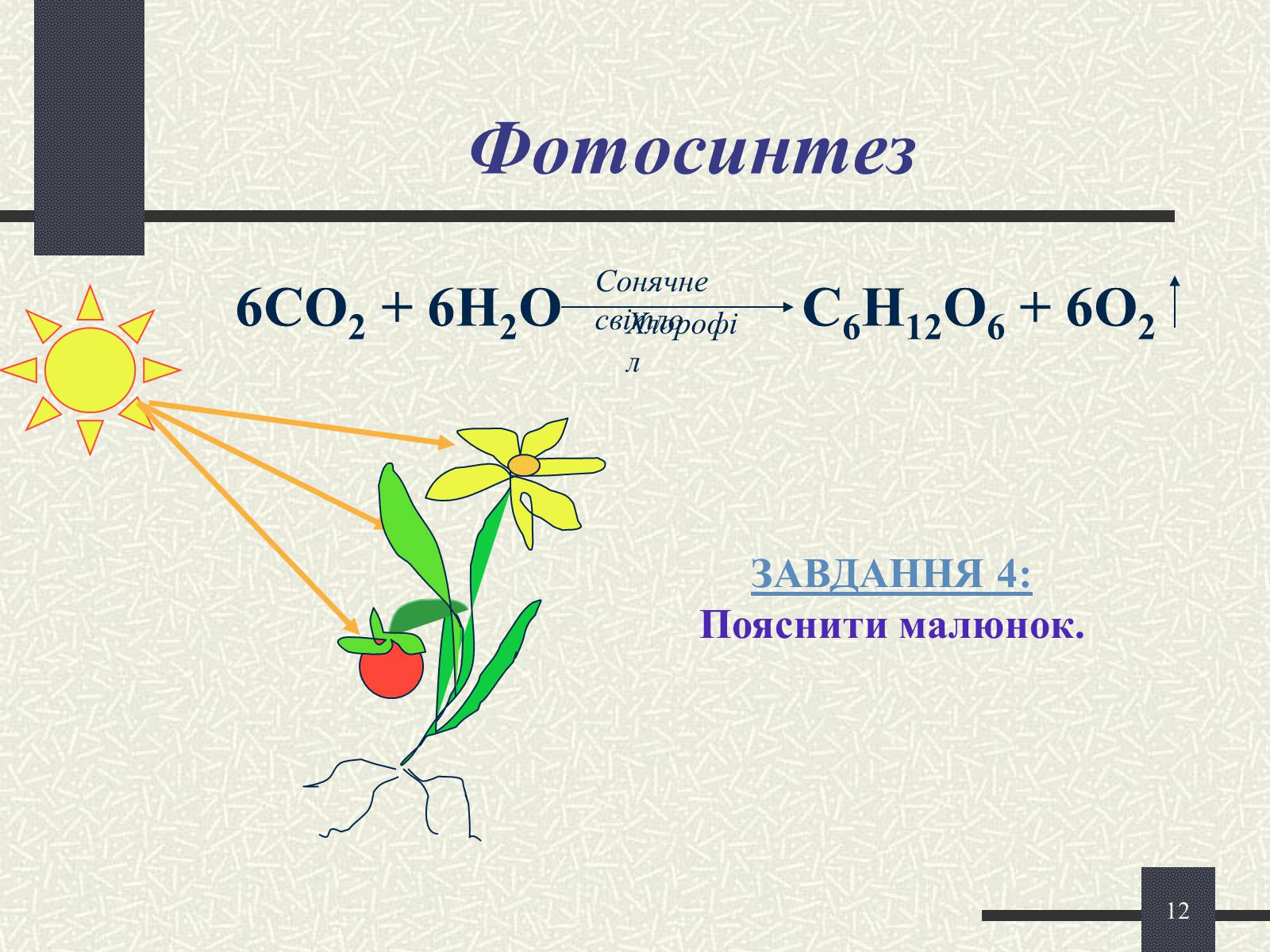
Фотосинтез
6СО2 + 6Н2О С6Н12О6 + 6О2
Сонячне світло
Хлорофіл
ЗАВДАННЯ 4:
Пояснити малюнок.
Фотосинтез
6СО2 + 6Н2О С6Н12О6 + 6О2
Сонячне світло
Хлорофіл
ЗАВДАННЯ 4:
Пояснити малюнок.
Слайд #13
13
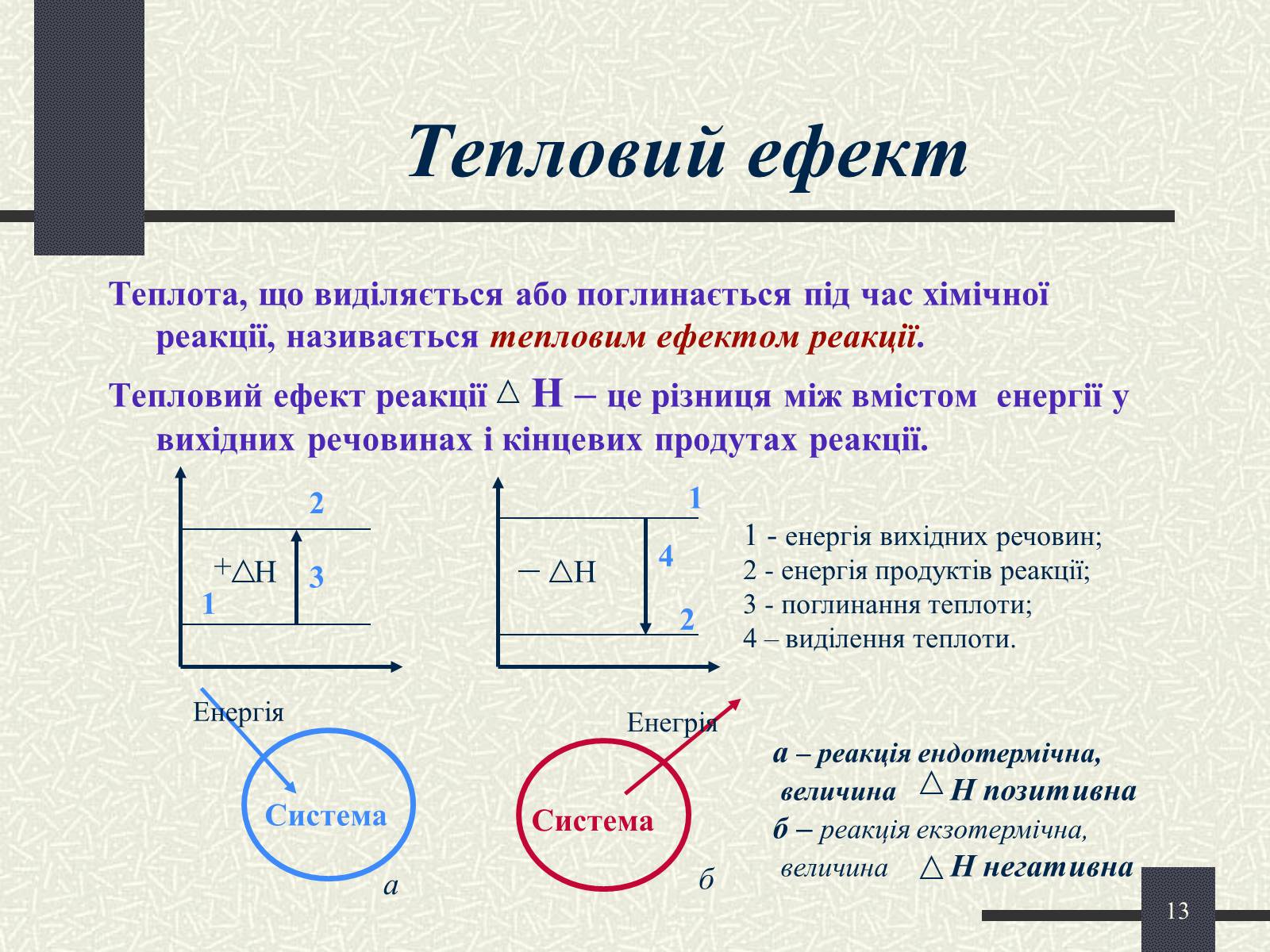
Тепловий ефект
Теплота, що виділяється або поглинається під час хімічної реакції, називається тепловим ефектом реакції.
Тепловий ефект реакції Н – це різниця між вмістом енергії у вихідних речовинах і кінцевих продутах реакції.
3
2
1
1
4
2
Н
+
Н
1 - енергія вихідних речовин;
2 - енергія продуктів реакції;
3 - поглинання теплоти;
4 – виділення теплоти.
а
б
а – реакція ендотермічна,
величина Н позитивна
б – реакція екзотермічна,
величина Н негативна
Система
Система
Енергія
Енегрія
Тепловий ефект
Теплота, що виділяється або поглинається під час хімічної реакції, називається тепловим ефектом реакції.
Тепловий ефект реакції Н – це різниця між вмістом енергії у вихідних речовинах і кінцевих продутах реакції.
3
2
1
1
4
2
Н
+
Н
1 - енергія вихідних речовин;
2 - енергія продуктів реакції;
3 - поглинання теплоти;
4 – виділення теплоти.
а
б
а – реакція ендотермічна,
величина Н позитивна
б – реакція екзотермічна,
величина Н негативна
Система
Система
Енергія
Енегрія
Слайд #14
14
Завдання для самоконтролю (1)
З наведених параметрів під час перебігу хімічної реакції завжди залишається незмінним (незмінною)
(1) маса; (2) об'єм; ( 3) тиск; (4) концентрація.
Рівнянням реакції Н2SO4 + 2NaOH = Na2SO4 + 2H2O подано процес
(1) розкладу; (2) сполучення; (3) нейтралізація; (4) заміщення.
Тепловий ефект реакції Н (кДж) перетворення речовини А на речовину В дорівнює
(1) +50; (2) –100; (3) +150; (4) –200; (5) +100; (6) –50.
А
В
Перебіг реакції
Енергія системи
кДж
50
100
150
200
250
Завдання для самоконтролю (1)
З наведених параметрів під час перебігу хімічної реакції завжди залишається незмінним (незмінною)
(1) маса; (2) об'єм; ( 3) тиск; (4) концентрація.
Рівнянням реакції Н2SO4 + 2NaOH = Na2SO4 + 2H2O подано процес
(1) розкладу; (2) сполучення; (3) нейтралізація; (4) заміщення.
Тепловий ефект реакції Н (кДж) перетворення речовини А на речовину В дорівнює
(1) +50; (2) –100; (3) +150; (4) –200; (5) +100; (6) –50.
А
В
Перебіг реакції
Енергія системи
кДж
50
100
150
200
250

Слайд #15
15
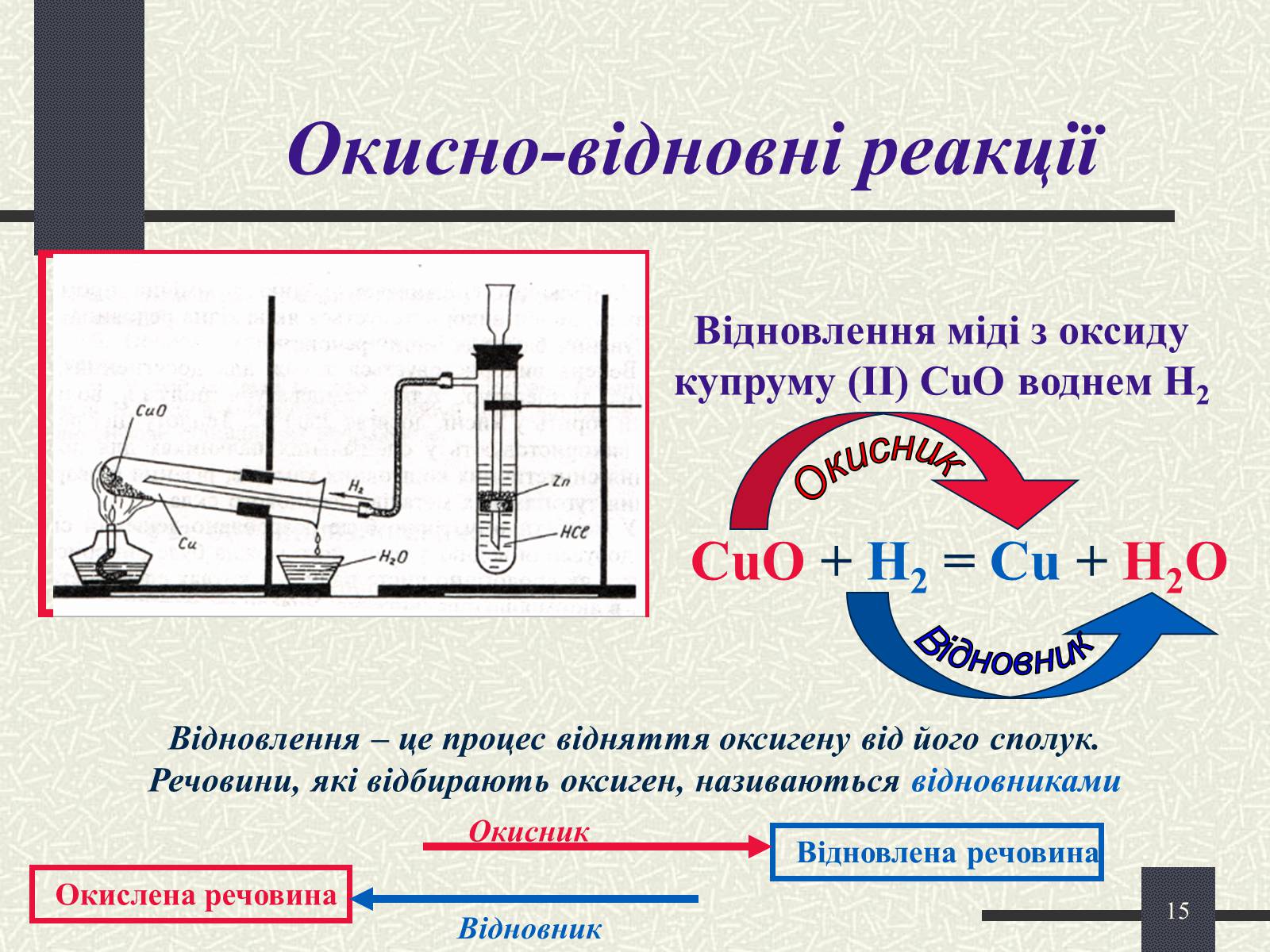
Окисно-відновні реакції
Відновлення міді з оксиду купруму (ІІ) CuO воднем Н2
CuO + H2 = Cu + H2O
Окисник
Відновник
Відновлення – це процес відняття оксигену від його сполук. Речовини, які відбирають оксиген, називаються відновниками
Окислена речовина
Відновлена речовина
Окисник
Відновник
Окисно-відновні реакції
Відновлення міді з оксиду купруму (ІІ) CuO воднем Н2
CuO + H2 = Cu + H2O
Окисник
Відновник
Відновлення – це процес відняття оксигену від його сполук. Речовини, які відбирають оксиген, називаються відновниками
Окислена речовина
Відновлена речовина
Окисник
Відновник
Слайд #16
16
Завдання для самоконтролю(2)
Скласти рівняння реакцій водню з такими речовинами: а) оксидом феруму(ІІІ); б)оксидом меркурію(ІІ); оксидом вольфраму(VІ).
Яка хімічна властивість водню виявляється в цих реакціях?
До якого типу реакцій вони належать?
Завдання для самоконтролю(2)
Скласти рівняння реакцій водню з такими речовинами: а) оксидом феруму(ІІІ); б)оксидом меркурію(ІІ); оксидом вольфраму(VІ).
Яка хімічна властивість водню виявляється в цих реакціях?
До якого типу реакцій вони належать?

Слайд #17
17
Швидкість хімічних реакцій
Хімічні реакції відбуваються з різною швидкістю
+
=
Кислота + Луг = Нейтральна речовина
МИТТЄВО!!!
+
Глина
Пісок
Протягом
століть
Швидкість хімічних реакцій
Хімічні реакції відбуваються з різною швидкістю
+
=
Кислота + Луг = Нейтральна речовина
МИТТЄВО!!!
+
Глина
Пісок
Протягом
століть

Слайд #18
18
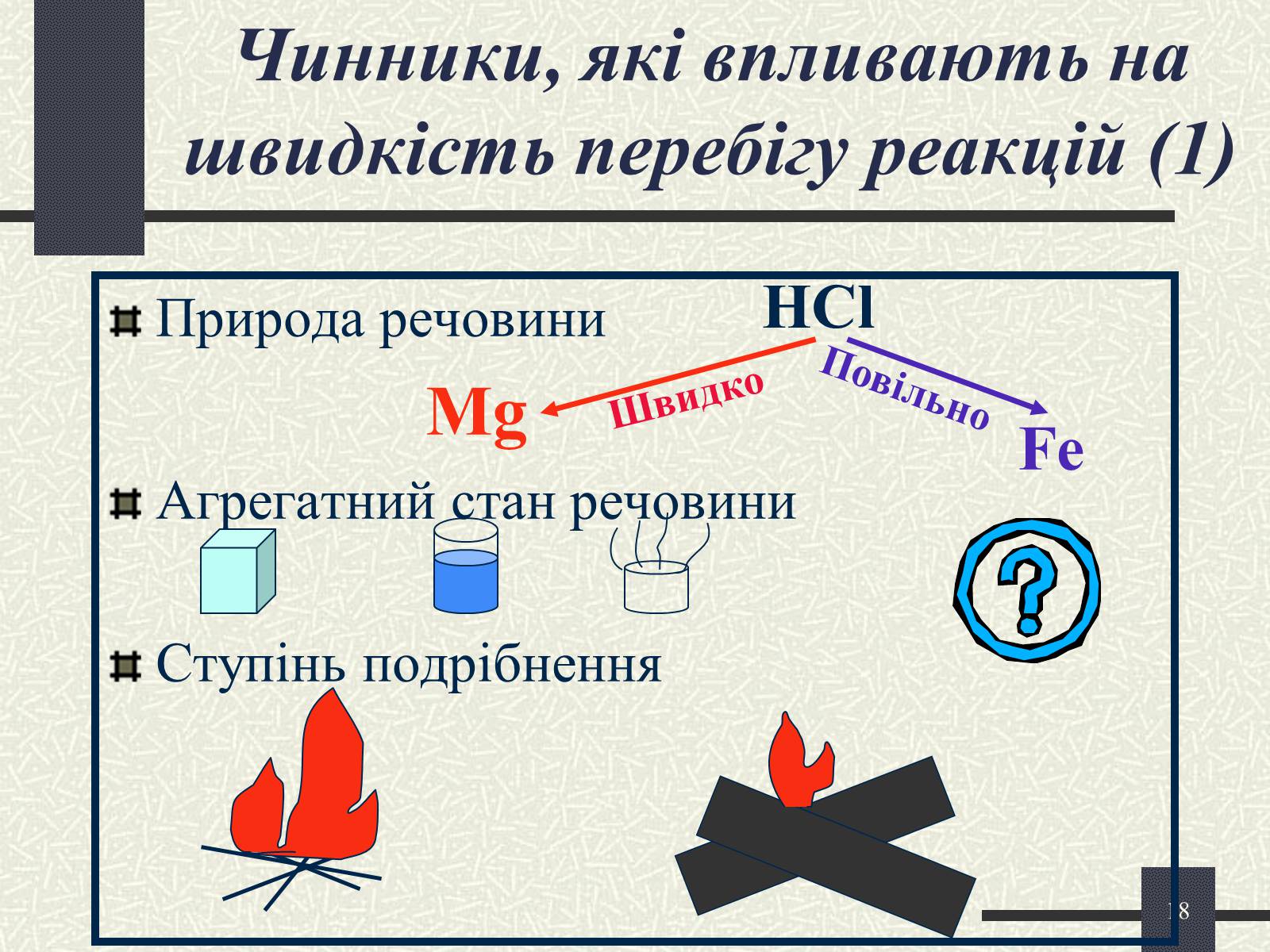
Чинники, які впливають на швидкість перебігу реакцій (1)
Природа речовини
Mg
Агрегатний стан речовини
Ступінь подрібнення
HCl
Fe
Повільно
Швидко
Чинники, які впливають на швидкість перебігу реакцій (1)
Природа речовини
Mg
Агрегатний стан речовини
Ступінь подрібнення
HCl
Fe
Повільно
Швидко
Слайд #19
19
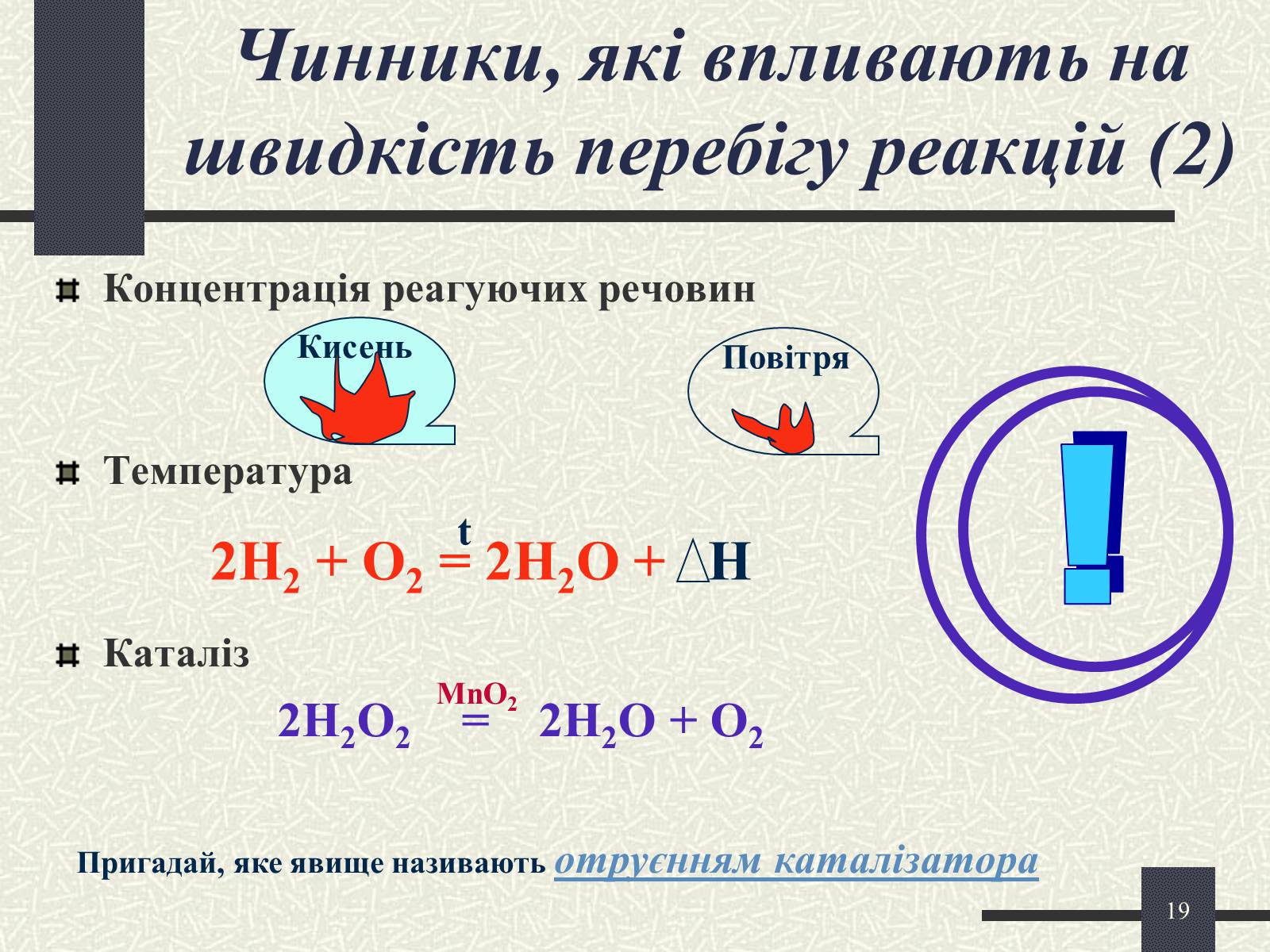
Чинники, які впливають на швидкість перебігу реакцій (2)
Концентрація реагуючих речовин
Температура
Каталіз
2H2O2 = 2H2O + O2
Кисень
Повітря
2H2 + O2 = 2H2O + Н
t
MnO2
Пригадай, яке явище називають отруєнням каталізатора
!
Чинники, які впливають на швидкість перебігу реакцій (2)
Концентрація реагуючих речовин
Температура
Каталіз
2H2O2 = 2H2O + O2
Кисень
Повітря
2H2 + O2 = 2H2O + Н
t
MnO2
Пригадай, яке явище називають отруєнням каталізатора
!
Слайд #20
20
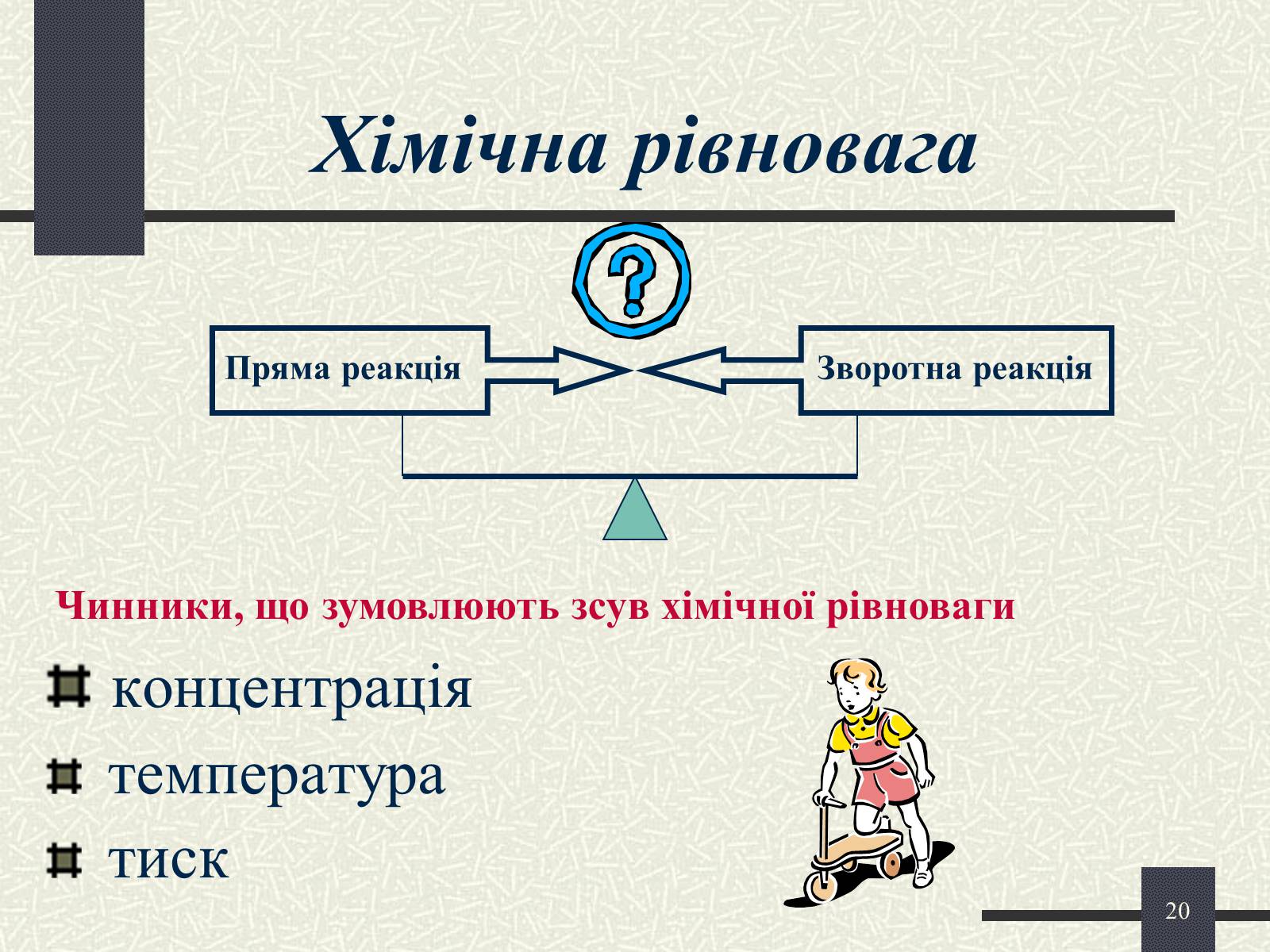
Хімічна рівновага
концентрація
температура
тиск
Чинники, що зумовлюють зсув хімічної рівноваги
Пряма реакція
Зворотна реакція
Хімічна рівновага
концентрація
температура
тиск
Чинники, що зумовлюють зсув хімічної рівноваги
Пряма реакція
Зворотна реакція
Слайд #21
21
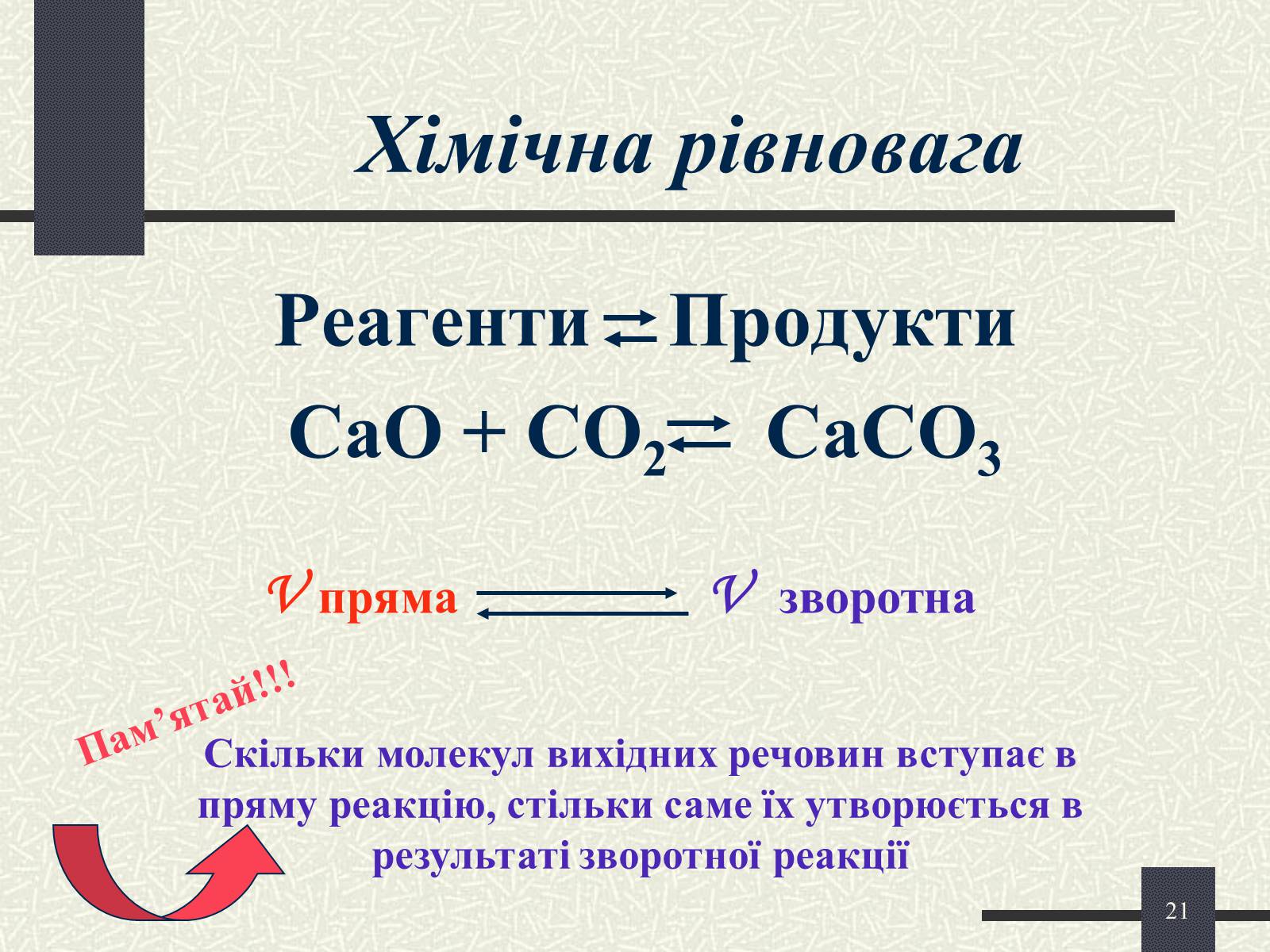
Хімічна рівновага
Реагенти Продукти
CaO + CO2 CaCO3
V пряма
V зворотна
Скільки молекул вихідних речовин вступає в пряму реакцію, стільки саме їх утворюється в результаті зворотної реакції
Пам'ятай!!!
Хімічна рівновага
Реагенти Продукти
CaO + CO2 CaCO3
V пряма
V зворотна
Скільки молекул вихідних речовин вступає в пряму реакцію, стільки саме їх утворюється в результаті зворотної реакції
Пам'ятай!!!
Слайд #22
22
Завдання для самоконтролю(3)
Що таке хімічна рівновага й чому вона називається динамічною?
Написати рівняння і зазначити, що оборотною буде реакція між: а) Na2SiO3 і H2SO4; б) CaO і HCl; в) NaOH і Al(OH)3; г) Na і O2
Із названих нижче чинників на стан хімічної рівноваги не впливає а) температура; б) тиск; в) концентрація реагуючих речовин; г) збільшення площі поверхні реагуючих речовин.
Завдання для самоконтролю(3)
Що таке хімічна рівновага й чому вона називається динамічною?
Написати рівняння і зазначити, що оборотною буде реакція між: а) Na2SiO3 і H2SO4; б) CaO і HCl; в) NaOH і Al(OH)3; г) Na і O2
Із названих нижче чинників на стан хімічної рівноваги не впливає а) температура; б) тиск; в) концентрація реагуючих речовин; г) збільшення площі поверхні реагуючих речовин.

Слайд #23
Домашнє завдвння:
Вивчити конспект
§11
23
Вивчити конспект
§11
23
