- Головна
- Готові шкільні презентації
- Презентація на тему «Основи» (варіант 4)
Презентація на тему «Основи» (варіант 4)
285
Слайд #1
План:
Основні відомості
Формули основ
Назви основ
Класифікація
Фізичні властивості
Хімічні властивості
Способи добування
Використання основ
Основи
Основні відомості
Формули основ
Назви основ
Класифікація
Фізичні властивості
Хімічні властивості
Способи добування
Використання основ
Основи

Слайд #2
Основні відомості
Основа-сполука,що складається із катіонів металічного елемента Me і гідроксид-аніонів ОН
Гідроксильна група, або гідроксогрупа, утворюється з молекул води Н20:
Н—ОН
Основа-сполука,що складається із катіонів металічного елемента Me і гідроксид-аніонів ОН
Гідроксильна група, або гідроксогрупа, утворюється з молекул води Н20:
Н—ОН

Слайд #3
Загальна формула основ
Ме(ОН)n,
де Ме — метал, а n — валентність цього металу, належать до класу основ.
Ме(ОН)n,
де Ме — метал, а n — валентність цього металу, належать до класу основ.

Слайд #4
Назви основ
назва металу
+
Валентність римскими цифрами
+
слово “гідроксид”
назва металу
+
Валентність римскими цифрами
+
слово “гідроксид”

Слайд #5
Наприклад
NaOH — натрій гідроксид, Al(OH)3 — алюміній гідроксид.
Для металів, що мають змінну валентність, у дужках після назви металу римською цифрою зазначають його валентність в даному гідроксиді.
Наприклад, Fe(OH)3 — ферум(ІІІ) гідроксид, Fe(OH)2 — ферум(ІІ) гідроксид
NaOH — натрій гідроксид, Al(OH)3 — алюміній гідроксид.
Для металів, що мають змінну валентність, у дужках після назви металу римською цифрою зазначають його валентність в даному гідроксиді.
Наприклад, Fe(OH)3 — ферум(ІІІ) гідроксид, Fe(OH)2 — ферум(ІІ) гідроксид

Слайд #6
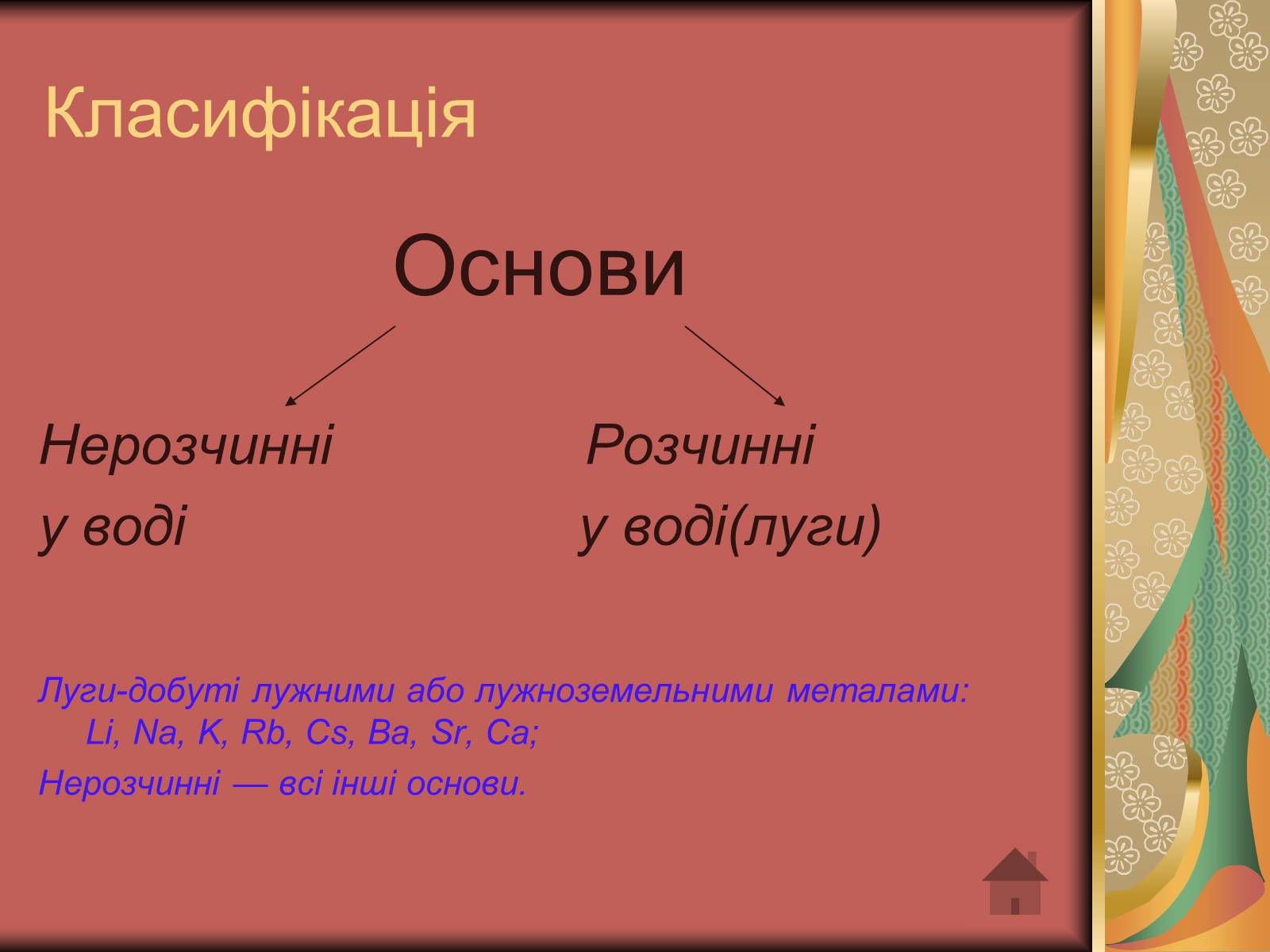
Класифікація
Основи
Нерозчинні Розчинні
у воді у воді(луги)
Луги-добуті лужними або лужноземельними металами:Li, Nа, K, Rb, Сs, Ba, Sr, Ca;
Нерозчинні — всі інші основи.
Основи
Нерозчинні Розчинні
у воді у воді(луги)
Луги-добуті лужними або лужноземельними металами:Li, Nа, K, Rb, Сs, Ba, Sr, Ca;
Нерозчинні — всі інші основи.
Слайд #7
Фізичні властивості
За нормальних умов усі луги — тверді речовини білого кольору, милкі на дотик, їдкі, роз'їдають шкіру, тканини, папір. Нерозчинні основи — тверді речовини різного кольору.
Працюючм з лугами та їхніми розчинами,будьте особливо обережними!
За нормальних умов усі луги — тверді речовини білого кольору, милкі на дотик, їдкі, роз'їдають шкіру, тканини, папір. Нерозчинні основи — тверді речовини різного кольору.
Працюючм з лугами та їхніми розчинами,будьте особливо обережними!

Слайд #8
Хімічні властивості
Луги мають такі хімічні властивості:
1) змінюють забарвлення індикаторів: фенолфталеїну без кольору на малинове, метилового оранжевого на жовте, фіолетового лакмусу на синє, універсального індикаторного паперу на синє;
2)взаємодіють із кислотними оксидами:
Луг+кислотний оксид=сіль+вода
3) взаємодіють із кислотами:
Луг+кислота=сіль+вода
4) реагують із солями:
Луг+сіль=основа+сіль
Луги мають такі хімічні властивості:
1) змінюють забарвлення індикаторів: фенолфталеїну без кольору на малинове, метилового оранжевого на жовте, фіолетового лакмусу на синє, універсального індикаторного паперу на синє;
2)взаємодіють із кислотними оксидами:
Луг+кислотний оксид=сіль+вода
3) взаємодіють із кислотами:
Луг+кислота=сіль+вода
4) реагують із солями:
Луг+сіль=основа+сіль

Слайд #9
Нерозчинні основи мають такі хімічні властивості:
1) не змінюють забарвлення індикаторів;
2) практично не взаємодіють із кислотними оксидами;
3) взаємодіють із кислотами:
Основа+кислота=сіль+вода
4) розкладаються при нагріванні:
Основа=оксид+вода
1) не змінюють забарвлення індикаторів;
2) практично не взаємодіють із кислотними оксидами;
3) взаємодіють із кислотами:
Основа+кислота=сіль+вода
4) розкладаються при нагріванні:
Основа=оксид+вода

Слайд #10
Способи добування
Розчинні у воді основи, тобто луги, добувають під час взаємодії металів або їх оксидів з водою:
2Na + 2H2O =2NaOH + H2
Сполучення основного оксиду з водою:
Na2O + H2O = 2NaOH
Малорозчинні у воді основи добувають непрямим шляхом, а саме: дією лугів на воді розчини відповідних солей
FeSo4 + 2NaOH Fe(OH)2 + NaSO4
AlCl3 + 3NaOH Al(OH)3 3NaCl
Розчинні у воді основи, тобто луги, добувають під час взаємодії металів або їх оксидів з водою:
2Na + 2H2O =2NaOH + H2
Сполучення основного оксиду з водою:
Na2O + H2O = 2NaOH
Малорозчинні у воді основи добувають непрямим шляхом, а саме: дією лугів на воді розчини відповідних солей
FeSo4 + 2NaOH Fe(OH)2 + NaSO4
AlCl3 + 3NaOH Al(OH)3 3NaCl

Слайд #11
Широкого застосування серед основ
набули лише луги,передусім
гідроксиди Кальцію
і Натрію.Гашене вапно викорис
товують як в'яжучий матеріал у
будівництві. Кальцій гідроксид
також застосовують у цукровій
промисловості,сільському
господарстві,при виготовленні
зубних паст.Натрій гідроксид
використовують для виробництва
мила,ліків,для очистки нафти.
Використання
набули лише луги,передусім
гідроксиди Кальцію
і Натрію.Гашене вапно викорис
товують як в'яжучий матеріал у
будівництві. Кальцій гідроксид
також застосовують у цукровій
промисловості,сільському
господарстві,при виготовленні
зубних паст.Натрій гідроксид
використовують для виробництва
мила,ліків,для очистки нафти.
Використання
