- Головна
- Готові шкільні презентації
- Презентація на тему «Етилен і ацетилен – ненасичені вуглеводні»
Презентація на тему «Етилен і ацетилен – ненасичені вуглеводні»
695
Слайд #1
Етилен і ацетилен – ненасичені вуглеводні
Ткаченко Ірина Іванівна,
вчитель хімії
Черкаської загальноосвітньої
школи I-III ступенів № 21
Ткаченко Ірина Іванівна,
вчитель хімії
Черкаської загальноосвітньої
школи I-III ступенів № 21

Слайд #2
Щоб пізнати –
треба навчитися спостерігати
треба навчитися спостерігати

Слайд #3
М е т а
ознайомитися із основними фізико-хімічними властивостями, будовою та застосуванням етилену і ацетилену;
навчитися складати рівняння реакцій, що характеризують хімічні властивості ненасичених вуглеводнів;
навчитися встановлювати причинно-наслідкові зв'язки між будовою і властивостями
ознайомитися із основними фізико-хімічними властивостями, будовою та застосуванням етилену і ацетилену;
навчитися складати рівняння реакцій, що характеризують хімічні властивості ненасичених вуглеводнів;
навчитися встановлювати причинно-наслідкові зв'язки між будовою і властивостями

Слайд #4
План
1. Поняття про ненасичені вуглеводні. Номенклатура.
2. Будова молекул етену та етину.
3. Фізичні властивості, добування.
4. Хімічні властивості етену та етину.
5. Застосування ненасичених вуглеводнів.
1. Поняття про ненасичені вуглеводні. Номенклатура.
2. Будова молекул етену та етину.
3. Фізичні властивості, добування.
4. Хімічні властивості етену та етину.
5. Застосування ненасичених вуглеводнів.

Слайд #5
Ненасичені вуглеводні – органічні сполуки, що мають кратні зв'язки між атомами Карбону (подвійні – С = С – або потрійні – С Ξ С – )
Етиленові вуглеводні - органічні сполуки, що мають один подвійний зв'язок між атомами Карбону.
Загальна формула СnH2n
С2Н4 - етен (етилен)
С3Н6 - пропен
С4Н8 - бутен
Ацетиленові вуглеводні - органічні сполуки, що мають один потрійний зв'язок між атомами Карбону.
Загальна формула - СnH2n - 2
С2Н2 - етин (ацетилен)
С3Н4 - пропін
С4Н6 - бутин
Етиленові вуглеводні - органічні сполуки, що мають один подвійний зв'язок між атомами Карбону.
Загальна формула СnH2n
С2Н4 - етен (етилен)
С3Н6 - пропен
С4Н8 - бутен
Ацетиленові вуглеводні - органічні сполуки, що мають один потрійний зв'язок між атомами Карбону.
Загальна формула - СnH2n - 2
С2Н2 - етин (ацетилен)
С3Н4 - пропін
С4Н6 - бутин

Слайд #6
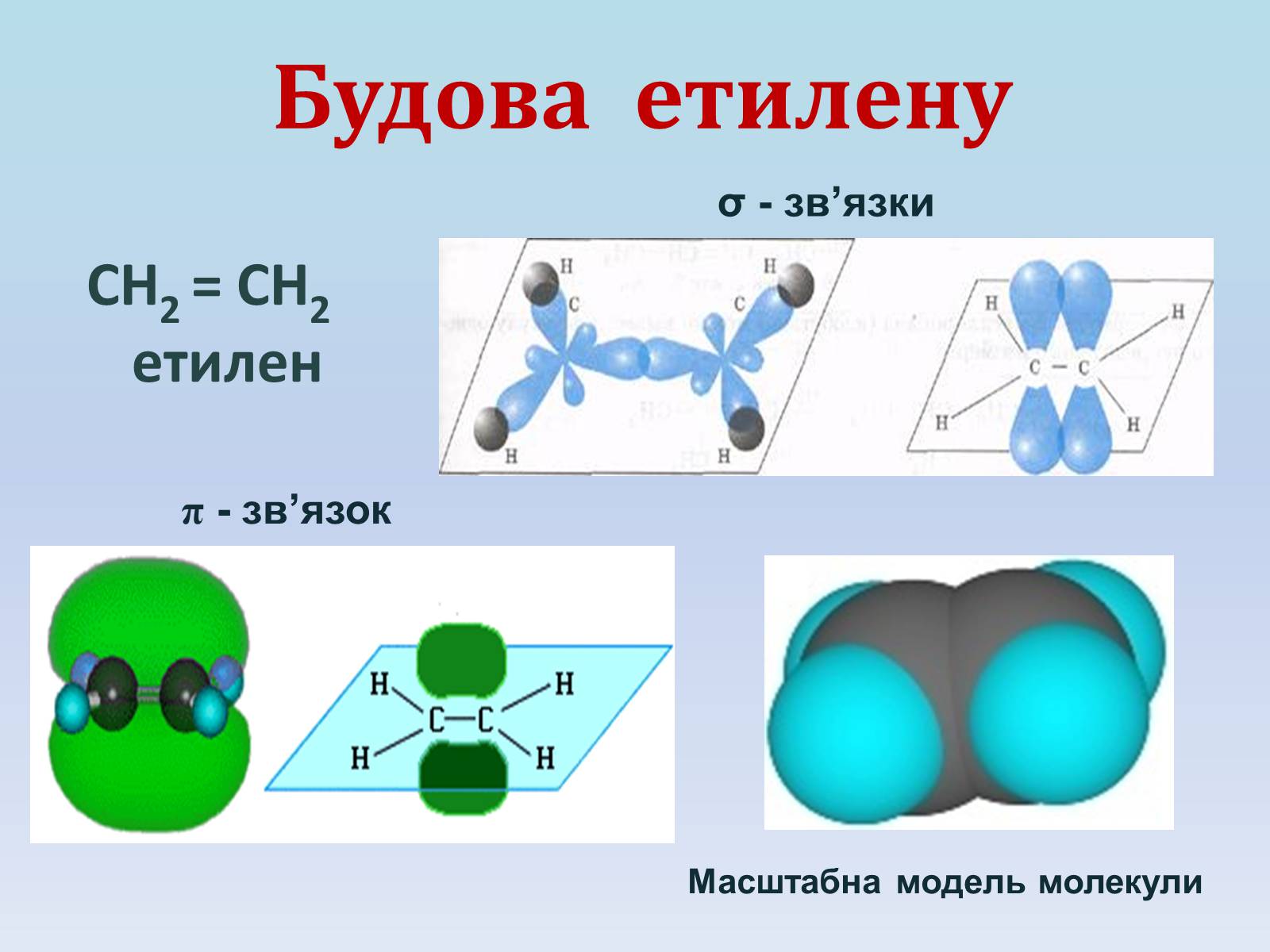
Будова етилену
СН2 = СН2
етилен
σ - зв'язки
π - зв'язок
Масштабна модель молекули
СН2 = СН2
етилен
σ - зв'язки
π - зв'язок
Масштабна модель молекули
Слайд #7
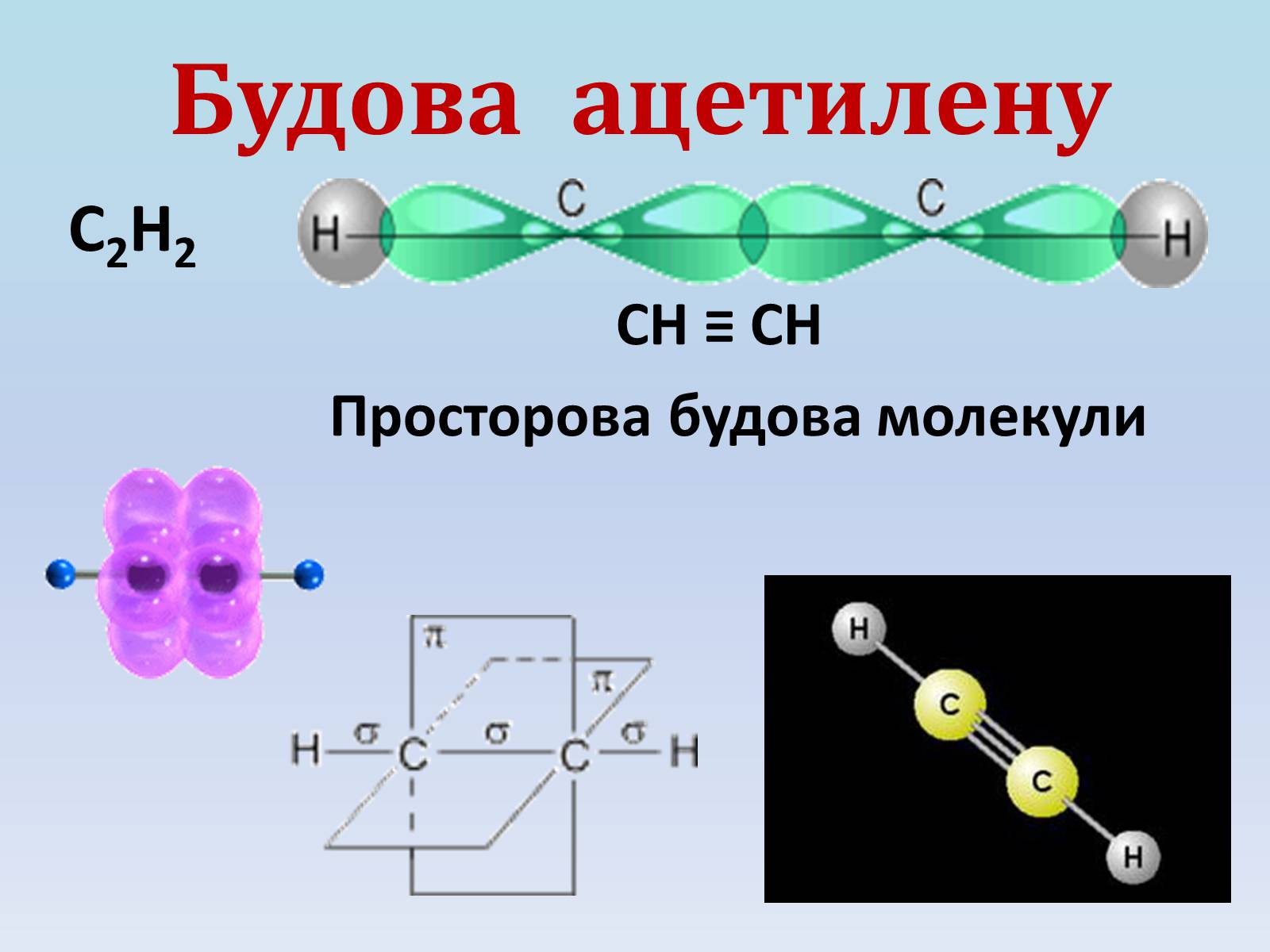
Будова ацетилену
С2Н2
СН ≡ СН
Просторова будова молекули
С2Н2
СН ≡ СН
Просторова будова молекули
Слайд #8
Фізичні властивості етилену
С2Н4
безбарвний газ;
добре розчинний в органічних розчинниках;
tплавл = - 169,2 ̊С;
вибухонебезпечний
С2Н4
безбарвний газ;
добре розчинний в органічних розчинниках;
tплавл = - 169,2 ̊С;
вибухонебезпечний

Слайд #9
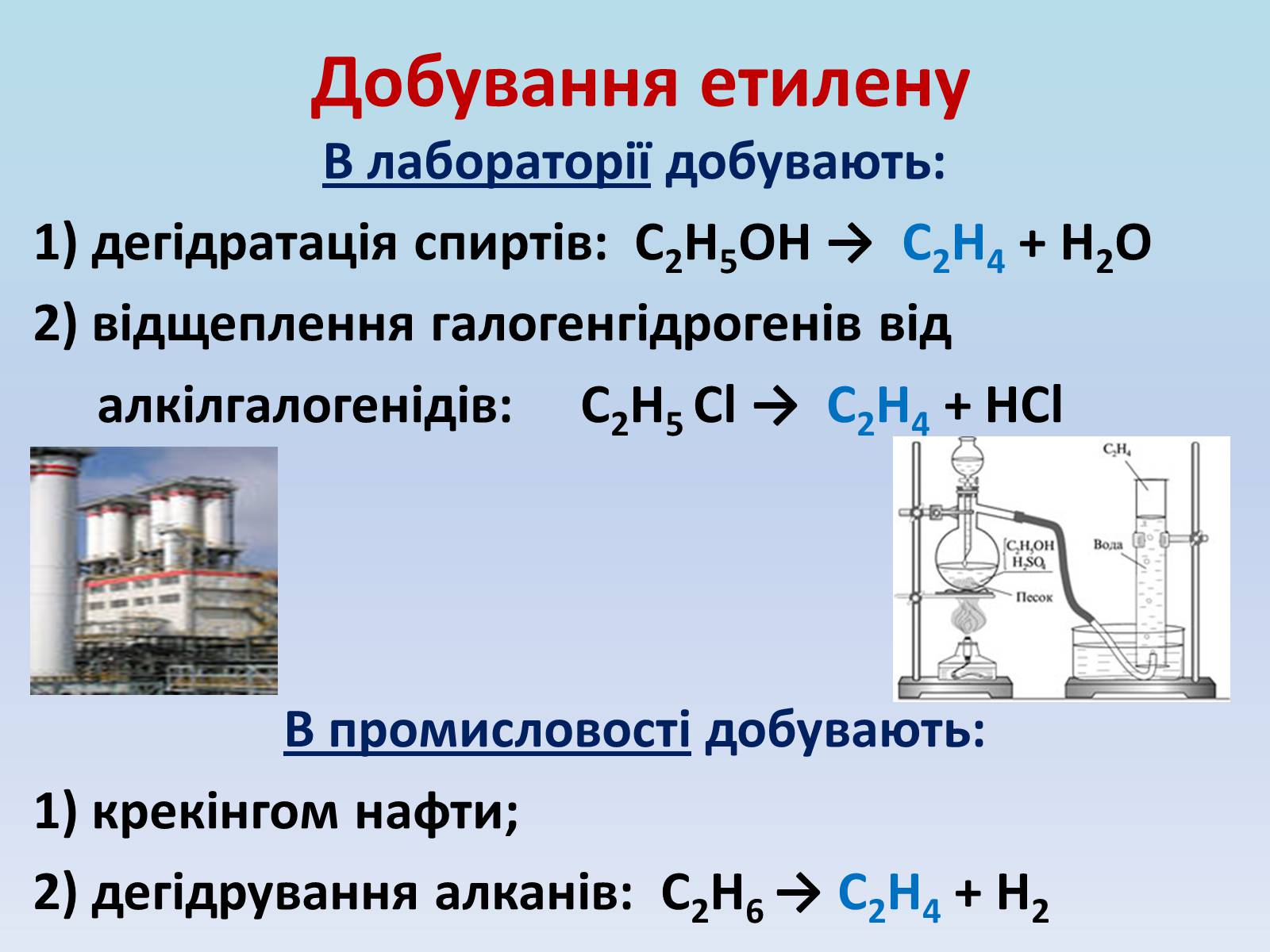
Добування етилену
В лабораторії добувають:
1) дегідратація спиртів: С2Н5ОН → С2Н4 + Н2О
2) відщеплення галогенгідрогенів від
алкілгалогенідів: С2Н5 Cl → С2Н4 + НCl
В промисловості добувають:
1) крекінгом нафти;
2) дегідрування алканів: С2Н6 → С2Н4 + Н2
В лабораторії добувають:
1) дегідратація спиртів: С2Н5ОН → С2Н4 + Н2О
2) відщеплення галогенгідрогенів від
алкілгалогенідів: С2Н5 Cl → С2Н4 + НCl
В промисловості добувають:
1) крекінгом нафти;
2) дегідрування алканів: С2Н6 → С2Н4 + Н2
Слайд #10
Фізичні властивості
С2Н2
безбарвний газ;
майже без запаху;
малорозчинний у воді, але під тиском добре розчиняється у ацетоні;
tкип = - 84 ̊С;
легший за повітря;
вибухонебезпечний
С2Н2
безбарвний газ;
майже без запаху;
малорозчинний у воді, але під тиском добре розчиняється у ацетоні;
tкип = - 84 ̊С;
легший за повітря;
вибухонебезпечний

Слайд #11
Добування ацетилену
1836р. - відкритий Е. Деві при розкладанні
водою калій карбіду.
1862р. - М. Бертло (франц.) вперше синтезув
із вуглецю і водню: 2С + Н2 → С2Н2
1. Карбідний метод: СаС2 + 2Н2О → С2Н2 + Са(ОН)2
2. Піроліз метану: t=1500ºС
2 СН4 → C2H2 + 3H2
Добування в лабораторії
C2H2 ацетилен
1836р. - відкритий Е. Деві при розкладанні
водою калій карбіду.
1862р. - М. Бертло (франц.) вперше синтезув
із вуглецю і водню: 2С + Н2 → С2Н2
1. Карбідний метод: СаС2 + 2Н2О → С2Н2 + Са(ОН)2
2. Піроліз метану: t=1500ºС
2 СН4 → C2H2 + 3H2
Добування в лабораторії
C2H2 ацетилен

Слайд #12
Хімічні властивості етилену
Горіння (з виділенням великої кількості теплоти): tС2Н4 + 3O2 → 2СО2 +2Н2О
2. Реакції приєднання по місцю розриву
π - зв'язку: СН2 = СН2
а) гідрування - приєднання водню: С2Н4 + Н2→ С2Н6
б) галогенування - приєднання галогенів:
С2Н4 + Br2 →С2Н4Br2
Якісне визначення ненасичених
вуглеводнів - знебарвлення розчину
калій перманганату і бромної води
Горіння (з виділенням великої кількості теплоти): tС2Н4 + 3O2 → 2СО2 +2Н2О
2. Реакції приєднання по місцю розриву
π - зв'язку: СН2 = СН2
а) гідрування - приєднання водню: С2Н4 + Н2→ С2Н6
б) галогенування - приєднання галогенів:
С2Н4 + Br2 →С2Н4Br2
Якісне визначення ненасичених
вуглеводнів - знебарвлення розчину
калій перманганату і бромної води

Слайд #13
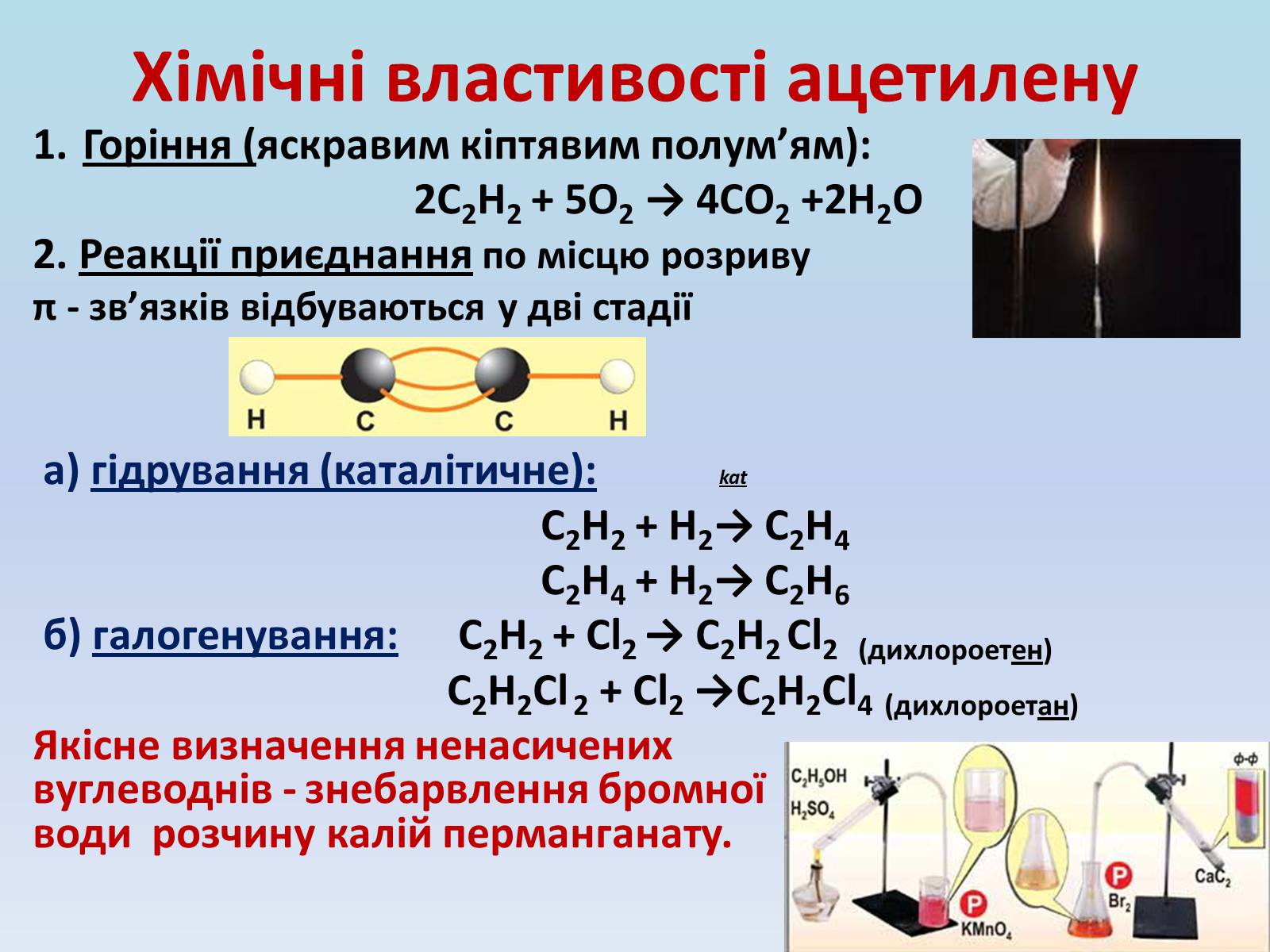
Хімічні властивості ацетилену
Горіння (яскравим кіптявим полум'ям):
2С2Н2 + 5O2 → 4СО2 +2Н2О
2. Реакції приєднання по місцю розриву
π - зв'язків відбуваються у дві стадії
а) гідрування (каталітичне): kat
С2Н2 + Н2→ С2Н4
С2Н4 + Н2→ С2Н6
б) галогенування: С2Н2 + Cl2 → С2Н2 Cl2 (дихлороетен)
С2Н2Cl 2 + Cl2 →С2Н2Cl4 (дихлороетан)
Якісне визначення ненасичених вуглеводнів - знебарвлення бромної води розчину калій перманганату.
Горіння (яскравим кіптявим полум'ям):
2С2Н2 + 5O2 → 4СО2 +2Н2О
2. Реакції приєднання по місцю розриву
π - зв'язків відбуваються у дві стадії
а) гідрування (каталітичне): kat
С2Н2 + Н2→ С2Н4
С2Н4 + Н2→ С2Н6
б) галогенування: С2Н2 + Cl2 → С2Н2 Cl2 (дихлороетен)
С2Н2Cl 2 + Cl2 →С2Н2Cl4 (дихлороетан)
Якісне визначення ненасичених вуглеводнів - знебарвлення бромної води розчину калій перманганату.
Слайд #14
Застосування
Етилен
Ацетилен
Висока реакційна здатність зумовлює використання в хімічній промисловості для добування етанолу та етиленгліколю
Використовують для дозрівання плодів
Використовують для добування полімеру поліетилену
70% ацетилену використовується для потреб органічного синтезу: виробництво етанолу, ацетальдегіду, оцтової кислоти, полімерів, синтетичних каучуків, органічних розчинників
30% ацетилену використовується для автогенного зварювання і різання металів
Етилен
Ацетилен
Висока реакційна здатність зумовлює використання в хімічній промисловості для добування етанолу та етиленгліколю
Використовують для дозрівання плодів
Використовують для добування полімеру поліетилену
70% ацетилену використовується для потреб органічного синтезу: виробництво етанолу, ацетальдегіду, оцтової кислоти, полімерів, синтетичних каучуків, органічних розчинників
30% ацетилену використовується для автогенного зварювання і різання металів

Слайд #15
Дайте відповіді на питання
1. Ацетилен у лабораторії добувають взаємодією:
а) кальцій силікату і води; tб) кальцій карбонату і воду;
в) кальцій карбіду і води; tг) етену та води.
2. Скільки спільних ковалентних електронних пар є між атомами Карбону в молекулі етилену ?
а) одна; t б) дві; t tв) три; tг) чотири
3. Яка загальна формула ненасичених вуглеводнів ряду ацетилену?
а) СnH2n; tб) СnH2n+2; tв) СnH2n+4; tг) СnH2n-2
4. Яка речовина належить до ненасичених вуглеводнів ряду етилену?
а) С2Н2; tб) С4Н10; tв) С2Н6; tг) С3Н6
5. Ненасичені вуглеводні можуть приєднувати:
а) галогени; б) галоген гідрогени;
в) лише водень; г) натрій хлорид
6. Вкажіть продукти реакції, що утворюються при гідруванні ацетилену:
а) етан; tб) пропан; tв) етен; tг) метан
1. Ацетилен у лабораторії добувають взаємодією:
а) кальцій силікату і води; tб) кальцій карбонату і воду;
в) кальцій карбіду і води; tг) етену та води.
2. Скільки спільних ковалентних електронних пар є між атомами Карбону в молекулі етилену ?
а) одна; t б) дві; t tв) три; tг) чотири
3. Яка загальна формула ненасичених вуглеводнів ряду ацетилену?
а) СnH2n; tб) СnH2n+2; tв) СnH2n+4; tг) СnH2n-2
4. Яка речовина належить до ненасичених вуглеводнів ряду етилену?
а) С2Н2; tб) С4Н10; tв) С2Н6; tг) С3Н6
5. Ненасичені вуглеводні можуть приєднувати:
а) галогени; б) галоген гідрогени;
в) лише водень; г) натрій хлорид
6. Вкажіть продукти реакції, що утворюються при гідруванні ацетилену:
а) етан; tб) пропан; tв) етен; tг) метан

Слайд #16
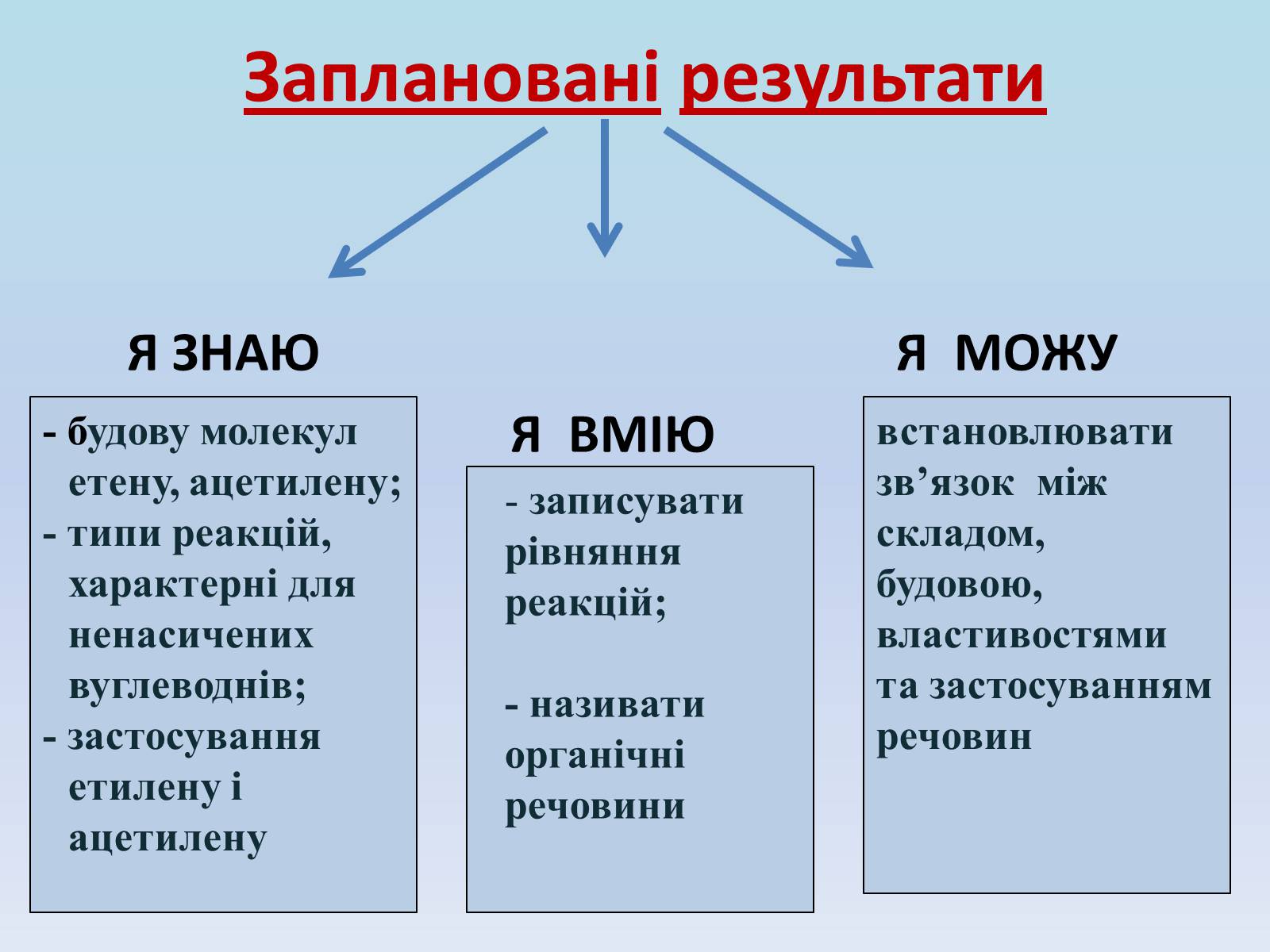
Заплановані результати
Я ЗНАЮ Я МОЖУ
Я ВМІЮ
- будову молекул етену, ацетилену;
- типи реакцій, характерні для ненасичених вуглеводнів;
- застосування етилену і ацетилену
записувати рівняння реакцій;
- називати органічні речовини
встановлювати зв'язок між складом, будовою, властивостями та застосуванням речовин
Я ЗНАЮ Я МОЖУ
Я ВМІЮ
- будову молекул етену, ацетилену;
- типи реакцій, характерні для ненасичених вуглеводнів;
- застосування етилену і ацетилену
записувати рівняння реакцій;
- називати органічні речовини
встановлювати зв'язок між складом, будовою, властивостями та застосуванням речовин
Слайд #17
Домашнє завдання
Вивчити відповідний матеріал підручника.
Вивчити основні поняття теми.
Виконати письмове завдання.
Вивчити відповідний матеріал підручника.
Вивчити основні поняття теми.
Виконати письмове завдання.
