- Головна
- Готові шкільні презентації
- Презентація на тему «Комплексні сполуки»
Презентація на тему «Комплексні сполуки»
489
Слайд #1
Комплексні сполуки

Слайд #2
План
1. Загальні відомості про комплексні сполуки.
2. Координаційні числа d-елементів.
3. Стабільність комплексів d-елементів.
1. Загальні відомості про комплексні сполуки.
2. Координаційні числа d-елементів.
3. Стабільність комплексів d-елементів.

Слайд #3
Комплексні сполуки
Комплексні сполуки або координаційні сполуки — складні хімічні сполуки, в яких можна виділити центральний атом (комплексоутворювач) і безпосередньо зв'язані з ним молекули або йони — так звані ліганди або аденти. Центральний атом та ліганди утворюють внутрішню сферу (комплекс); молекули або йони, які оточують комплекс — зовнішню координаційну сферу. Центральним атомом можуть бути як метали, так і неметали. Утворення комплексних сполук широко використовується в різноманітних галузях хімічної технології (виділення, очищення, розділення платинових, рідкісноземельних та деяких інших металів).
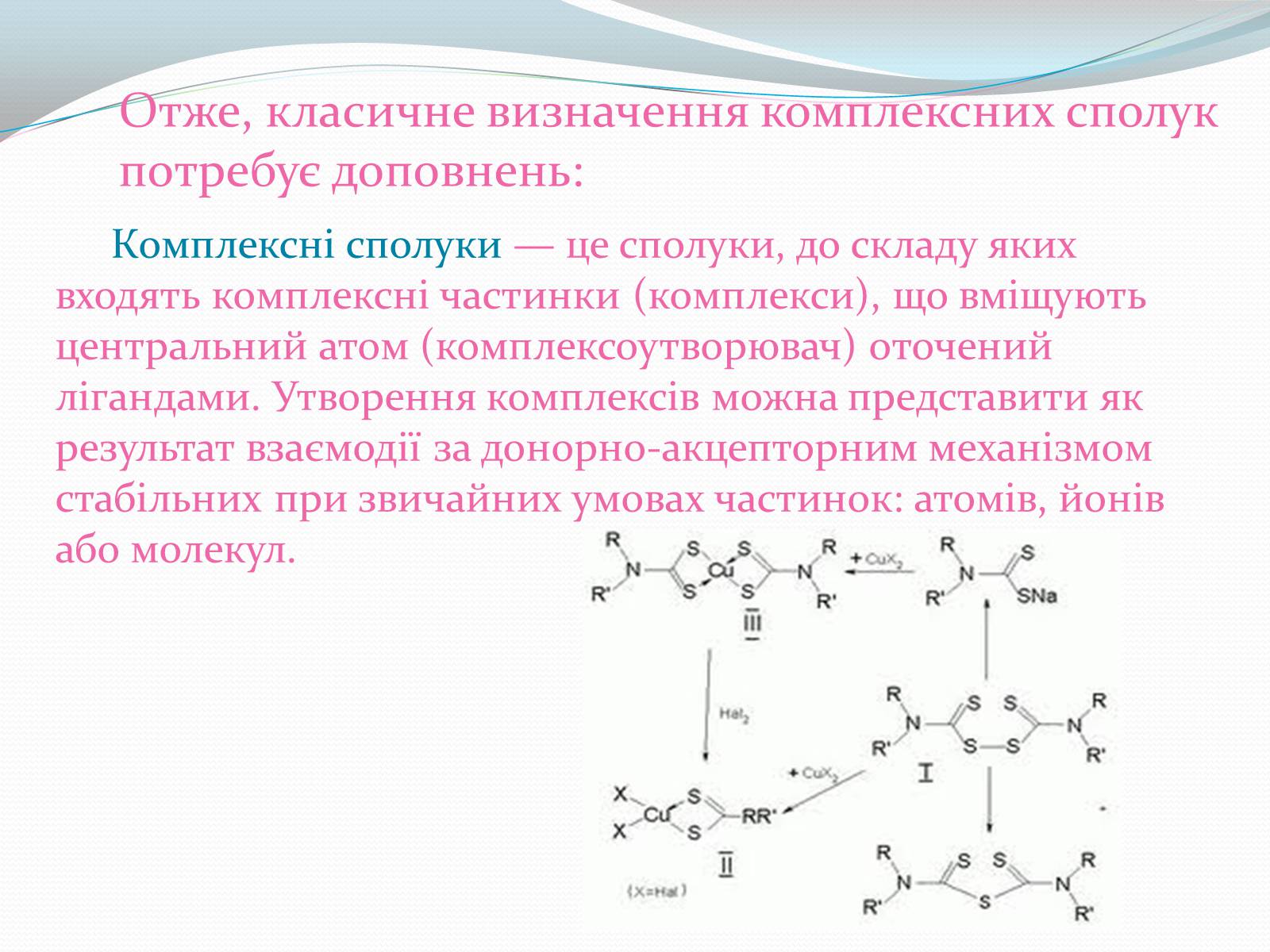
Ліганди і комплексні сполуки Cu (IІ)/Cu (IІI).
Комплексні сполуки або координаційні сполуки — складні хімічні сполуки, в яких можна виділити центральний атом (комплексоутворювач) і безпосередньо зв'язані з ним молекули або йони — так звані ліганди або аденти. Центральний атом та ліганди утворюють внутрішню сферу (комплекс); молекули або йони, які оточують комплекс — зовнішню координаційну сферу. Центральним атомом можуть бути як метали, так і неметали. Утворення комплексних сполук широко використовується в різноманітних галузях хімічної технології (виділення, очищення, розділення платинових, рідкісноземельних та деяких інших металів).
Ліганди і комплексні сполуки Cu (IІ)/Cu (IІI).

Слайд #4
Загальні відомості про комплексні сполуки
Хімія комплексних сполук є однією з галузей сучасної хімії, що інтенсивно розвиваються. У зв'язку з цим, поняття «комплексні сполуки» постійно уточнюється і доповнюється. Відповідно до класичного визначення, комплексні сполуки — це сполуки, до складу яких входять комплексні частинки, що вміщують центральний атом (комплексоутворювач) оточений лігандами.
Хімія комплексних сполук є однією з галузей сучасної хімії, що інтенсивно розвиваються. У зв'язку з цим, поняття «комплексні сполуки» постійно уточнюється і доповнюється. Відповідно до класичного визначення, комплексні сполуки — це сполуки, до складу яких входять комплексні частинки, що вміщують центральний атом (комплексоутворювач) оточений лігандами.

Слайд #5
За Ф. Коттоном і Дж. Уїлкінсоном дане визначення комплексних сполук потребує деяких уточнень:
-по-перше, комплексоутворювач і ліганди повинні бути стабільними при звичайних умовах;
-по-друге, реакції комплексоутворення повинні протікати у звичайних хімічних умовах.
-по-третє, до комплексних сполук слід віднести також продукти приєднання лігандів до молекул:
SiF4 + F- = SiF62-;
і продукти взаємодії молекул за донорно-акцепторних механізмом:
NH3 + BF3 = NH3BF3.
-по-перше, комплексоутворювач і ліганди повинні бути стабільними при звичайних умовах;
-по-друге, реакції комплексоутворення повинні протікати у звичайних хімічних умовах.
-по-третє, до комплексних сполук слід віднести також продукти приєднання лігандів до молекул:
SiF4 + F- = SiF62-;
і продукти взаємодії молекул за донорно-акцепторних механізмом:
NH3 + BF3 = NH3BF3.

Слайд #6
Отже, класичне визначення комплексних сполук потребує доповнень:
Комплексні сполуки — це сполуки, до складу яких входять комплексні частинки (комплекси), що вміщують центральний атом (комплексоутворювач) оточений лігандами. Утворення комплексів можна представити як результат взаємодії за донорно-акцепторним механізмом стабільних при звичайних умовах частинок: атомів, йонів або молекул.
Комплексні сполуки — це сполуки, до складу яких входять комплексні частинки (комплекси), що вміщують центральний атом (комплексоутворювач) оточений лігандами. Утворення комплексів можна представити як результат взаємодії за донорно-акцепторним механізмом стабільних при звичайних умовах частинок: атомів, йонів або молекул.
Слайд #7
Приведене вище визначення вказує, що, наприклад, такі частинки як CH4, SO42-, NO3- та інші недоцільно представляти як комплекси, оскільки частинки C+ і H-, S6+ і О2-, N5+ і О2- при звичайних умовах не існують.
Найбільш характерним комплексоутворення є саме для d-елементів.
Наявність значної кількості валентних частково заповнених орбіталей і схильність до утворення ковалентного зв'язку визначає значну кількість комплексних сполук, що утворюють d-елементи
Найбільш характерним комплексоутворення є саме для d-елементів.
Наявність значної кількості валентних частково заповнених орбіталей і схильність до утворення ковалентного зв'язку визначає значну кількість комплексних сполук, що утворюють d-елементи

Слайд #8
Координаційні числа d-елементів
Найбільш характерними координаційними числами d-елементів є 4 і 6 (наприклад: [Pt(NH3)4]Cl2, К2[Ni(CN)4], К4[Fe(CN)6], Na3[Co(NO2)6]). Менш характерним є координаційне число 2, яке, як правило, мають d-елементи у ступені окиснення +1, наприклад: [Ag(NH3)2]Cl, Na[Au(CN)2].
Координаційні числа вищі за 6 є мало характерними і зустрічаються лише для деяких d-елементів другого і третього рядів (МI3[ZrF7], МI4[ZrF8]). Величина координаційного числа визначається електронною будовою, а також розмірами комплексоутворювача і лігандів.
Найбільш характерними координаційними числами d-елементів є 4 і 6 (наприклад: [Pt(NH3)4]Cl2, К2[Ni(CN)4], К4[Fe(CN)6], Na3[Co(NO2)6]). Менш характерним є координаційне число 2, яке, як правило, мають d-елементи у ступені окиснення +1, наприклад: [Ag(NH3)2]Cl, Na[Au(CN)2].
Координаційні числа вищі за 6 є мало характерними і зустрічаються лише для деяких d-елементів другого і третього рядів (МI3[ZrF7], МI4[ZrF8]). Величина координаційного числа визначається електронною будовою, а також розмірами комплексоутворювача і лігандів.

Слайд #9
Стабільність комплексів d-елементів
Серед монодентантних лігандів найбільш стабільні комплекси з d-елементами утворюють ціанід-йон, аміак, галогенід-йони і деякі інші. Утворення ціанідних комплексів є характерним для елементів підгрупи Купруму, підгрупи Цинку і d-елементів VIII групи. Вказані вище елементи (за винятком Феруму) утворюють також досить стабільні аміачні комплекси. Всі d-елементи утворюють більш-менш стабільні галогенідні комплекси.
Найменш характерним комплексоутворення є для елементів підгрупи Скандію і Титану. Для даних елементів характерним є утворення фторидних комплексів складу МI3[ЭIIIF6] і МI4[ЭIVF6].
Також для визначення стабільності металорганічних комплексів користуються емпіричним правилом 18 електронів: стабільним буде той комплекс, на зовнішній валентній орбіталі якого є 18, як його власних електронів, так і електронів лігандів.
Серед монодентантних лігандів найбільш стабільні комплекси з d-елементами утворюють ціанід-йон, аміак, галогенід-йони і деякі інші. Утворення ціанідних комплексів є характерним для елементів підгрупи Купруму, підгрупи Цинку і d-елементів VIII групи. Вказані вище елементи (за винятком Феруму) утворюють також досить стабільні аміачні комплекси. Всі d-елементи утворюють більш-менш стабільні галогенідні комплекси.
Найменш характерним комплексоутворення є для елементів підгрупи Скандію і Титану. Для даних елементів характерним є утворення фторидних комплексів складу МI3[ЭIIIF6] і МI4[ЭIVF6].
Також для визначення стабільності металорганічних комплексів користуються емпіричним правилом 18 електронів: стабільним буде той комплекс, на зовнішній валентній орбіталі якого є 18, як його власних електронів, так і електронів лігандів.

Слайд #10
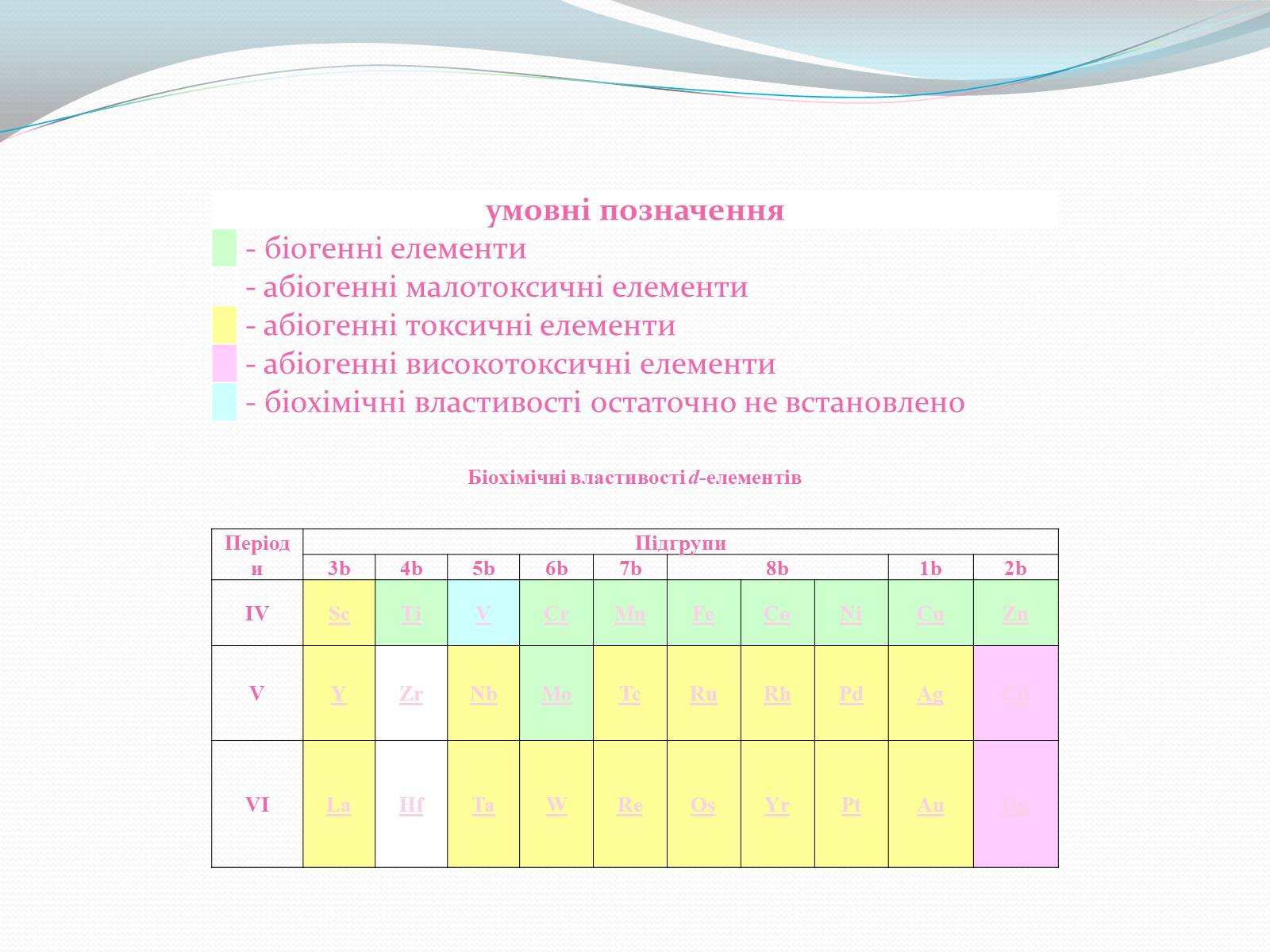
Біохімічні властивості d-елементів
Періоди
Підгрупи
3b
4b
5b
6b
7b
8b
1b
2b
IV
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
V
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
VI
La
Hf
Ta
W
Re
Os
Yr
Pt
Au
Hg
умовні позначення
- біогенні елементи
- абіогенні малотоксичні елементи
- абіогенні токсичні елементи
- абіогенні високотоксичні елементи
- біохімічні властивості остаточно не встановлено
Періоди
Підгрупи
3b
4b
5b
6b
7b
8b
1b
2b
IV
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
V
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
VI
La
Hf
Ta
W
Re
Os
Yr
Pt
Au
Hg
умовні позначення
- біогенні елементи
- абіогенні малотоксичні елементи
- абіогенні токсичні елементи
- абіогенні високотоксичні елементи
- біохімічні властивості остаточно не встановлено
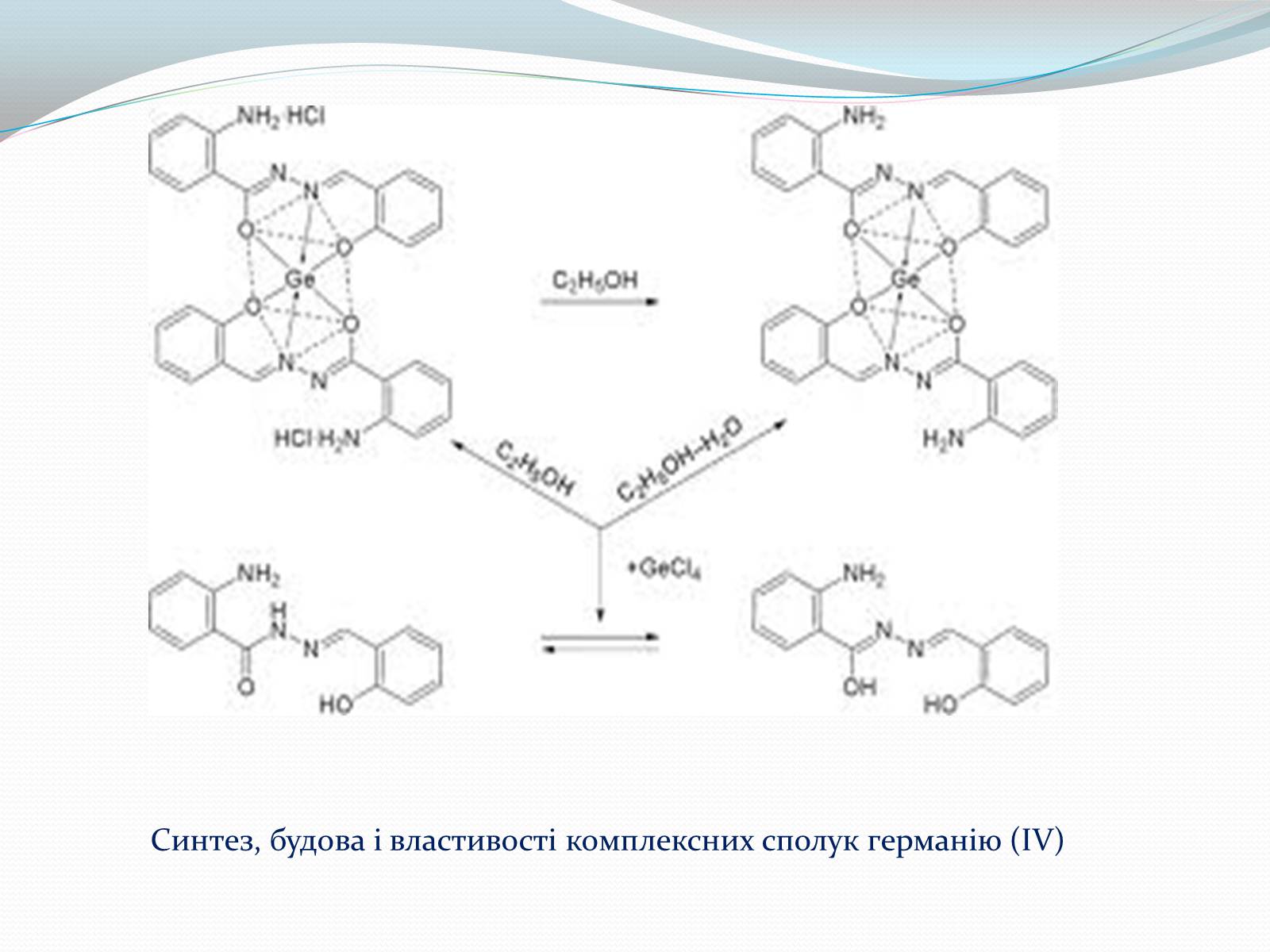
Слайд #11
Синтез, будова і властивості комплексних сполук германію (IV)
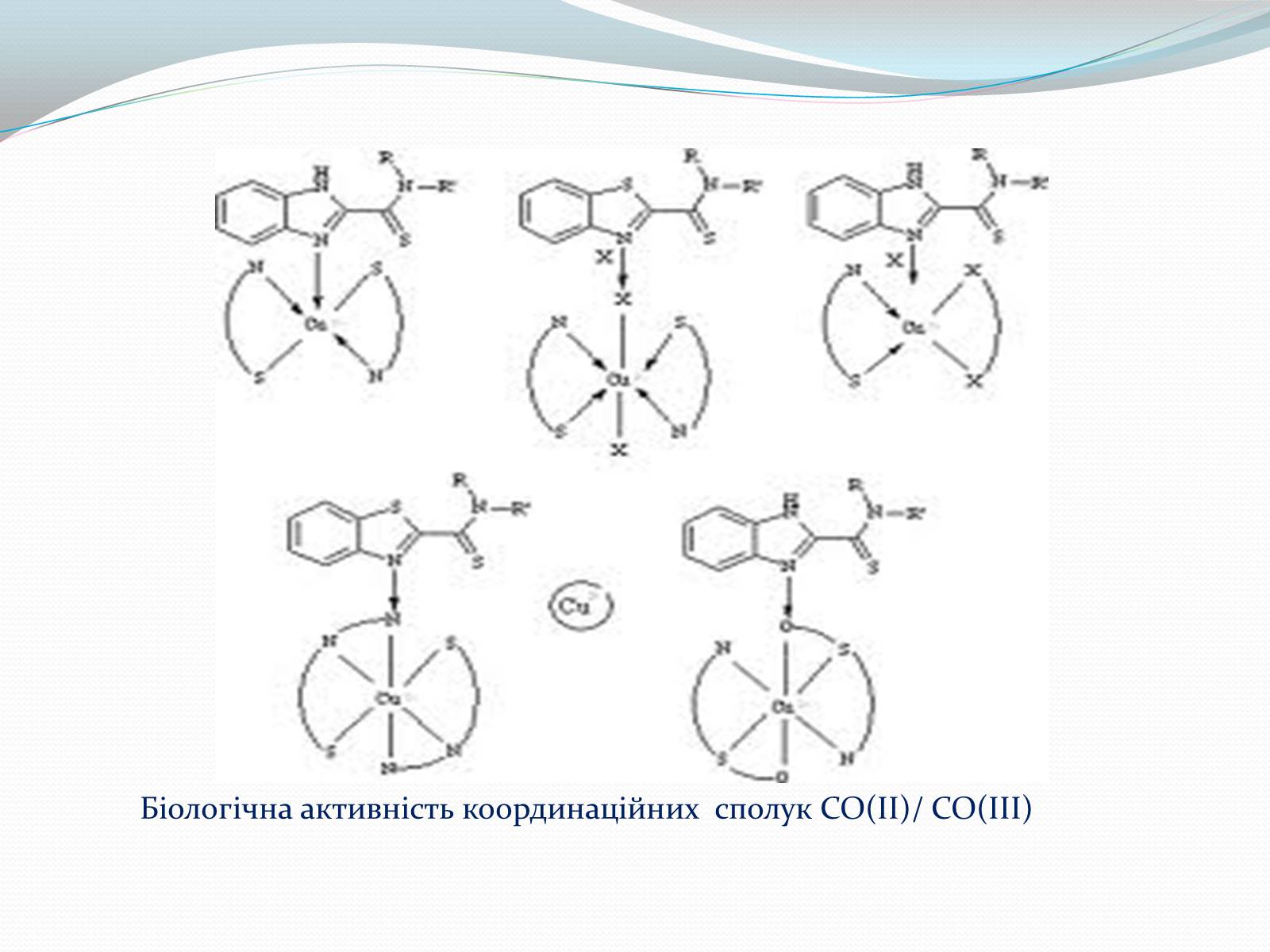
Слайд #12
Біологічна активність координаційних сполук СО(ІІ)/ СО(ІІІ)