- Головна
- Готові шкільні презентації
- Презентація на тему «Алюміній» (варіант 13)
Презентація на тему «Алюміній» (варіант 13)
249
Слайд #1
Алюміній

Слайд #2
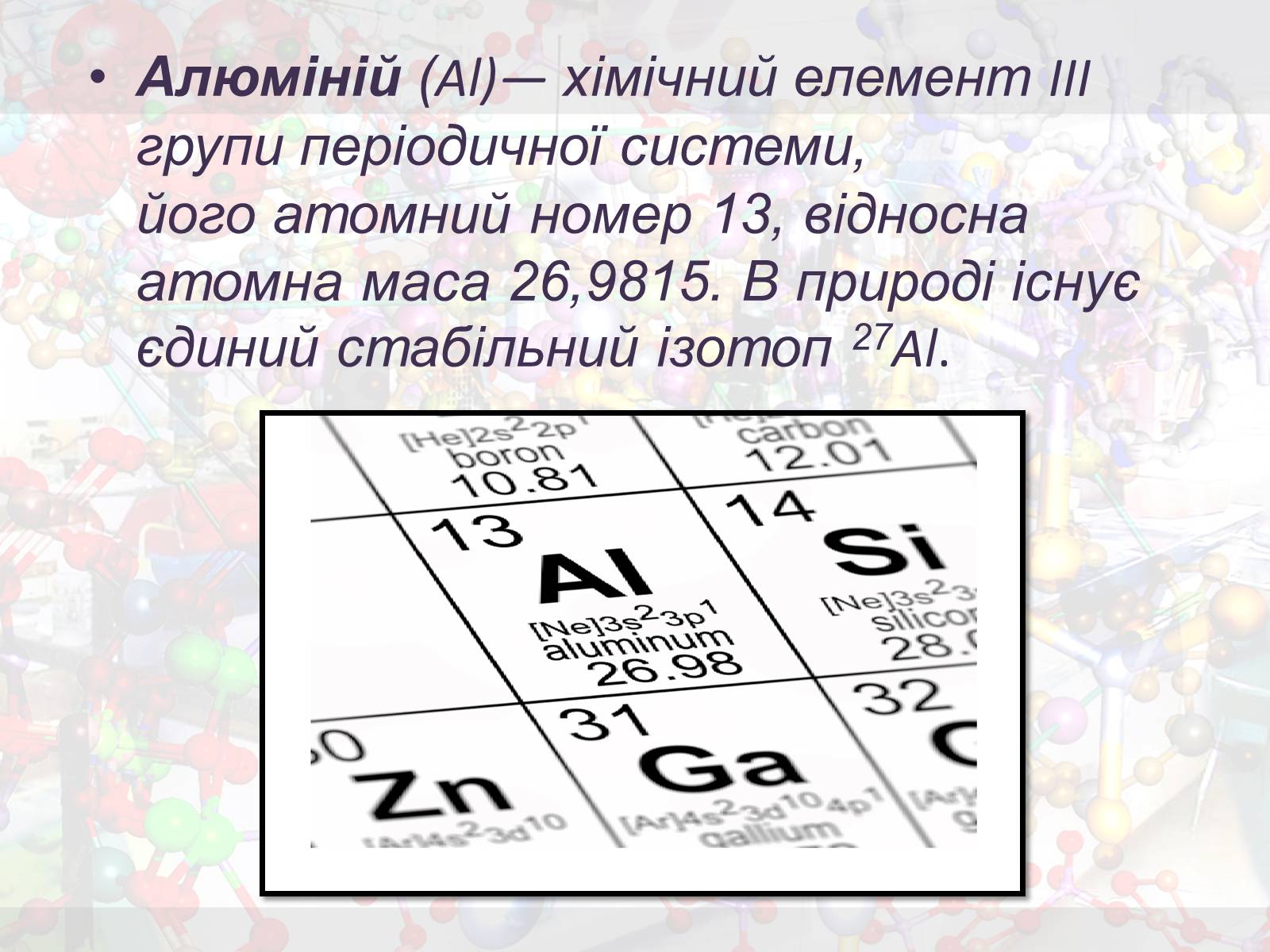
Алюміній (Al)— хімічний елемент III групи періодичної системи, його атомний номер 13, відносна атомна маса 26,9815. В природі існує єдиний стабільний ізотоп 27Al.
Слайд #3
Статуя Антероса на площі Піккаділлі в Лондоні, виготовлена в 1893 і є однією з перших статуй відлитих з алюмінію
Назва елемента походить
від латинського слова alumen –
галун. Галун – сполука Алюмінію,
яку здавна використовували
при фарбуванні тканин і
як засіб
для припинення кровотечі.
Назва елемента походить
від латинського слова alumen –
галун. Галун – сполука Алюмінію,
яку здавна використовували
при фарбуванні тканин і
як засіб
для припинення кровотечі.

Слайд #4
Поширення в природі
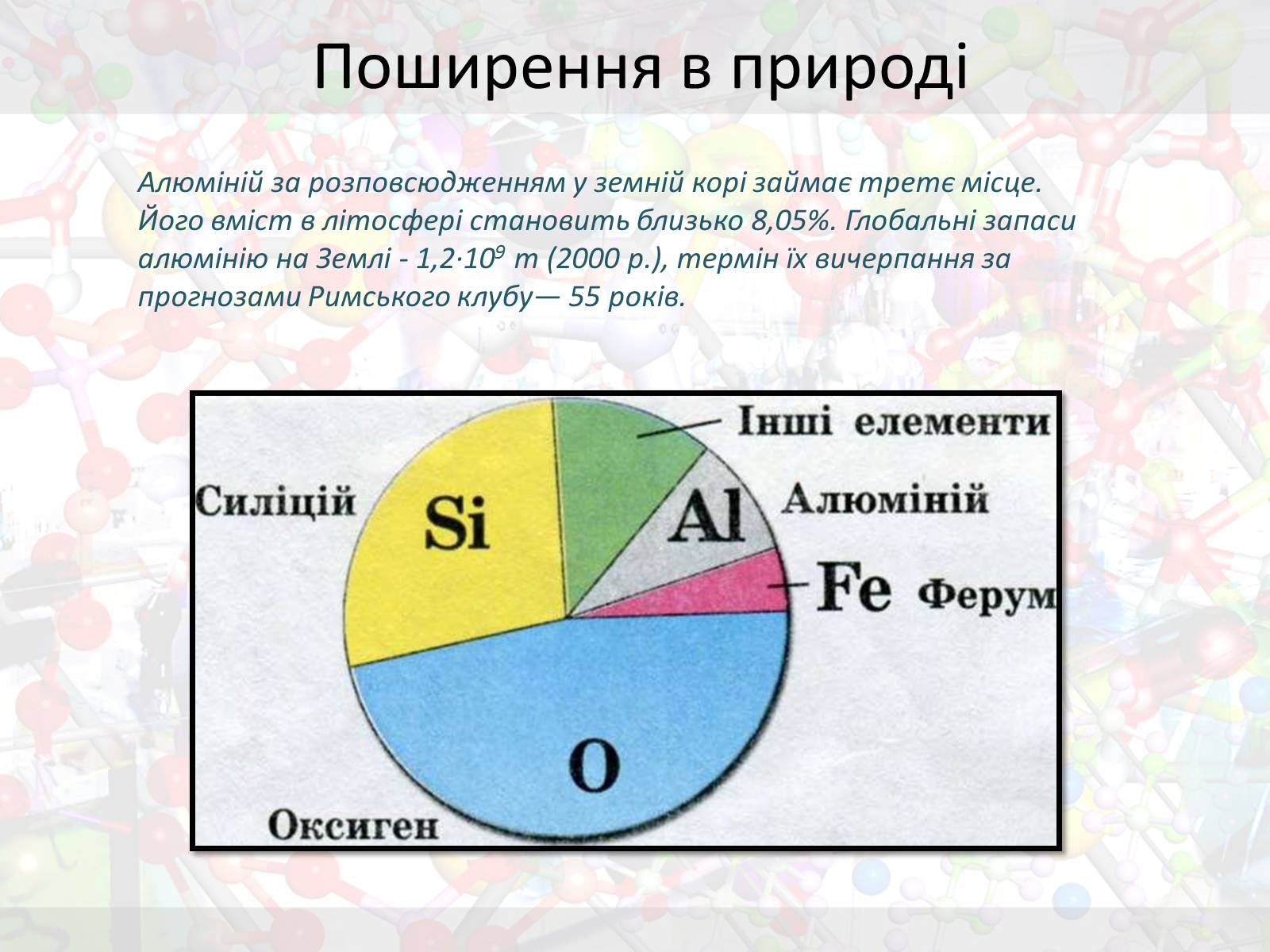
Алюміній за розповсюдженням у земній корі займає третє місце. Його вміст в літосфері становить близько 8,05%. Глобальні запаси алюмінію на Землі - 1,2·109 т (2000 р.), термін їх вичерпання за прогнозами Римського клубу— 55 років.
Алюміній за розповсюдженням у земній корі займає третє місце. Його вміст в літосфері становить близько 8,05%. Глобальні запаси алюмінію на Землі - 1,2·109 т (2000 р.), термін їх вичерпання за прогнозами Римського клубу— 55 років.
Слайд #5
В природі зустрічається винятково у вигляді сполук, входить до складу 270 мінералів. Його найважливішими мінералами є:
Боксит –суміш сполук із формулами Al(OH)3 і AlO(OH).
Каолініт Al4 [Si4O10] (OH)8.
Нефелін KNa3[AlSiO4]4 або (Na,K) Al[SiO4].
Боксит –суміш сполук із формулами Al(OH)3 і AlO(OH).
Каолініт Al4 [Si4O10] (OH)8.
Нефелін KNa3[AlSiO4]4 або (Na,K) Al[SiO4].

Слайд #6
Фізичні властивості
Алюмінію
сріблясто-білий легкий метал
Густина - 2,69872 г/см³
t = 6600C
добрий провідник тепла і електрики
пластичний
легко піддається механічній обробці
Алюмінію
сріблясто-білий легкий метал
Густина - 2,69872 г/см³
t = 6600C
добрий провідник тепла і електрики
пластичний
легко піддається механічній обробці

Слайд #7
Реакції з киснем
На повітрі він швидко окиснюється і вкривається тонкою плівкою алюміній оксиду. Оксидна плівка є досить міцною й зумовлює корозійну стійкість алюмінію. При нагріванні на повітрі чи в кисні алюміній згоряє, утворюючи також алюміній оксид:
4Al + 3O2 = 2Al2O3.
Реакції з водою
У звичайному стані алюміній покритий захисною оксидною плівкою і є стійким до дії води навіть при нагріванні. Якщо плівка алюміній оксиду буде зруйнована, то алюміній буде активно реагувати з водою з виділенням газуватого водню:
2Al + 6Н2О = 2Al(ОН)3↓ + 3Н2↑.
Хімічні властивості
На повітрі він швидко окиснюється і вкривається тонкою плівкою алюміній оксиду. Оксидна плівка є досить міцною й зумовлює корозійну стійкість алюмінію. При нагріванні на повітрі чи в кисні алюміній згоряє, утворюючи також алюміній оксид:
4Al + 3O2 = 2Al2O3.
Реакції з водою
У звичайному стані алюміній покритий захисною оксидною плівкою і є стійким до дії води навіть при нагріванні. Якщо плівка алюміній оксиду буде зруйнована, то алюміній буде активно реагувати з водою з виділенням газуватого водню:
2Al + 6Н2О = 2Al(ОН)3↓ + 3Н2↑.
Хімічні властивості

Слайд #8
Реакції з кислотами
Алюміній реагує з розчинами кислот з утворенням солей і водню, наприклад:
2Al + 6НСl= 2AlCl3 + 3Н2↑.
Концентровані сульфатна і нітратна кислоти пасивують алюміній, тобто збільшують міцність оксидної плівки. Таким чином, алюміній з ними не реагує.
Реакції з неметалами
Алюміній активно реагує з іншими неметалами. За звичайних умов він взаємодіє з хлором і бромом, утворюючи солі, наприклад, алюміній хлорид:
2Al + 3Сl2 = 2AlСl3.
Хімічні властивості
Алюміній реагує з розчинами кислот з утворенням солей і водню, наприклад:
2Al + 6НСl= 2AlCl3 + 3Н2↑.
Концентровані сульфатна і нітратна кислоти пасивують алюміній, тобто збільшують міцність оксидної плівки. Таким чином, алюміній з ними не реагує.
Реакції з неметалами
Алюміній активно реагує з іншими неметалами. За звичайних умов він взаємодіє з хлором і бромом, утворюючи солі, наприклад, алюміній хлорид:
2Al + 3Сl2 = 2AlСl3.
Хімічні властивості

Слайд #9
Реакції з лугами
Оксидна плівка легко розчиняється в лугах і алюміній реагує з розчинами лугів з виділенням водню:
2Al + 2NaOH +6Н2O = 2Na[Al(OH)4] + 3Н2↑.
Реакції з солями
Алюміній реагує з розчинами солей, “витісняючи” менш активні метали:
2Al+3CuCl2 = 3Cu + 2AlCl3
Хімічні властивості
Оксидна плівка легко розчиняється в лугах і алюміній реагує з розчинами лугів з виділенням водню:
2Al + 2NaOH +6Н2O = 2Na[Al(OH)4] + 3Н2↑.
Реакції з солями
Алюміній реагує з розчинами солей, “витісняючи” менш активні метали:
2Al+3CuCl2 = 3Cu + 2AlCl3
Хімічні властивості

Слайд #10
Починаючи з кінця 1930-х років, ведеться пошук нових методів пайки, спеціально призначених для алюмінію та його сплавів, одним з яких є ультразвукове паяння із застосуванням м'яких припоїв.

Слайд #11
Чистий алюміній застосовується у виробництві фольги, яка широко використовується для виробництва електролітичних конденсаторів і пакувальних матеріалів для харчових продуктів.
Різні види конденсаторів
Різні види конденсаторів

Слайд #12
Основна кількість провідникової продукції — голі, обмоткові і ізольовані проводи, кабелі в одно- і багатожилковому виконанні виробляють за двохстадійною технологією

Слайд #13
Кінець
Презентацію підготувала
Анжела Слюсаренко
Презентацію підготувала
Анжела Слюсаренко
