- Головна
- Готові шкільні презентації
- Презентація на тему «Амінокислоти. Пептиди. Білки»
Презентація на тему «Амінокислоти. Пептиди. Білки»
526
Слайд #1
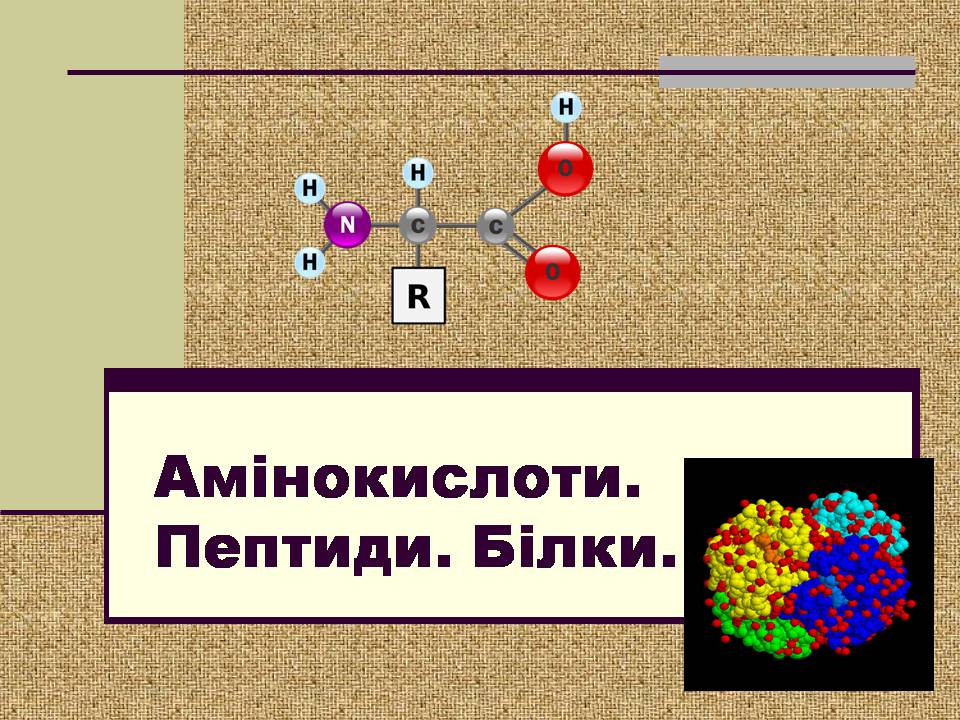
Амінокислоти. Пептиди. Білки.
Слайд #2
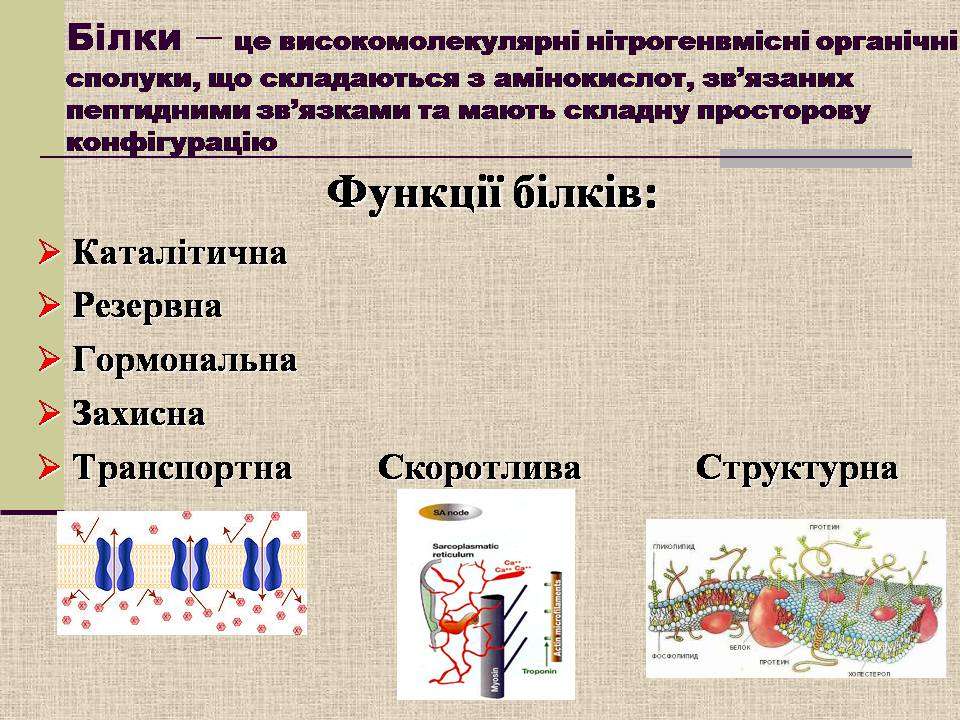
Білки – це високомолекулярні нітрогенвмісні органічні сполуки, що складаються з амінокислот, зв'язаних пептидними зв'язками та мають складну просторову конфігурацію
Функції білків:
Каталітична
Резервна
Гормональна
Захисна
Транспортна Скоротлива Структурна
Функції білків:
Каталітична
Резервна
Гормональна
Захисна
Транспортна Скоротлива Структурна
Слайд #3
Класифікації білків:
І. За молекулярною масою:
200-1000 Да - пептиди
1000-5000 Да - поліпептиди
> 5000 Да - білки
ІІ. За структурою:
Прості – складаються тільки з амінокислот
Складні – складаються з амінокислот та іншої небілкової частини
І. За молекулярною масою:
200-1000 Да - пептиди
1000-5000 Да - поліпептиди
> 5000 Да - білки
ІІ. За структурою:
Прості – складаються тільки з амінокислот
Складні – складаються з амінокислот та іншої небілкової частини

Слайд #4
Амінокислоти – гетерофункціональні сполуки, похідні карбонових кислот, у яких один атом гідрогену заміщений на аміногрупу
Амінокислоти поділяють на:
Незамінні: валін, лейцин,ізолейцин, лізин, треонін, метіонін, фенілаланін, триптофан –поступають ззовні.
Замінні – синтезуються в організмі людини
За хімічною природою радикалу:
аліфатичні
ароматичні
гетероциклічні
За кількістю карбоксильних та аміногруп:
Нейтральні (моноаміномонокарбонові)
Основні (диаміномонокарбонові)
Кислі (моноамінодикарбонові)
Амінокислоти поділяють на:
Незамінні: валін, лейцин,ізолейцин, лізин, треонін, метіонін, фенілаланін, триптофан –поступають ззовні.
Замінні – синтезуються в організмі людини
За хімічною природою радикалу:
аліфатичні
ароматичні
гетероциклічні
За кількістю карбоксильних та аміногруп:
Нейтральні (моноаміномонокарбонові)
Основні (диаміномонокарбонові)
Кислі (моноамінодикарбонові)

Слайд #5
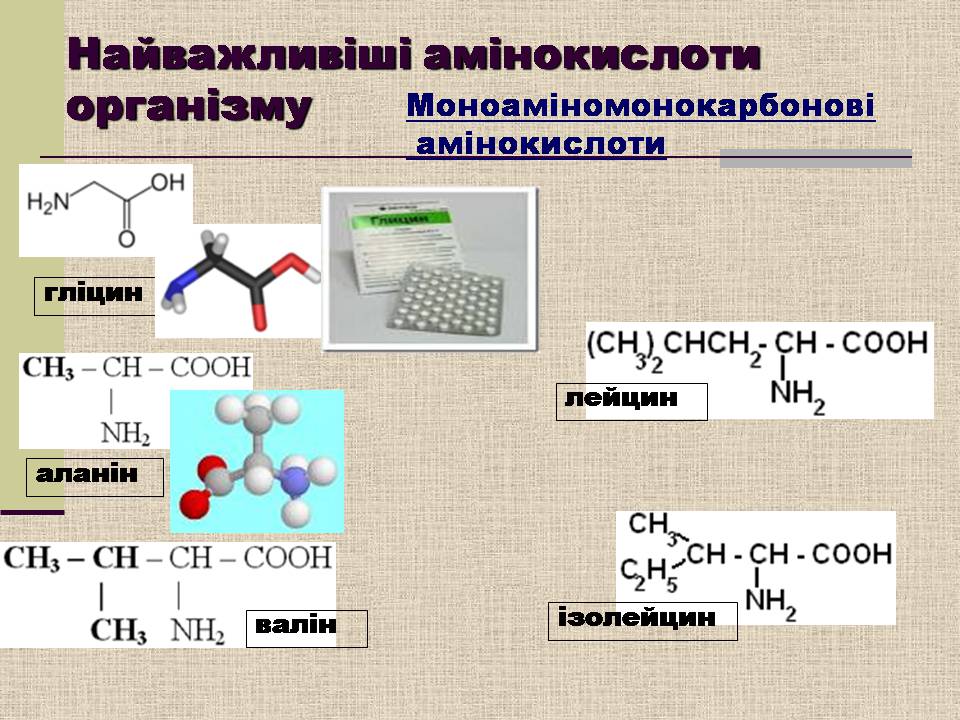
Найважливіші амінокислоти організму
гліцин
аланін
валін
лейцин
ізолейцин
Моноаміномонокарбонові
амінокислоти
гліцин
аланін
валін
лейцин
ізолейцин
Моноаміномонокарбонові
амінокислоти
Слайд #6
Найважливіші амінокислоти організму
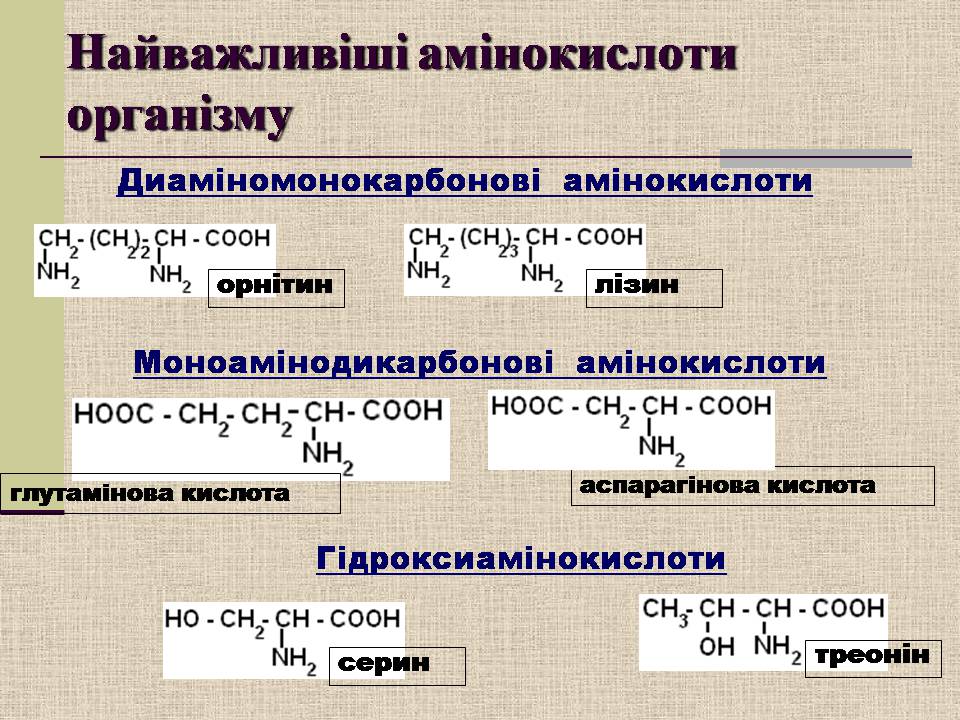
орнітин
лізин
треонін
Диаміномонокарбонові амінокислоти
Моноамінодикарбонові амінокислоти
глутамінова кислота
аспарагінова кислота
серин
Гідроксиамінокислоти
орнітин
лізин
треонін
Диаміномонокарбонові амінокислоти
Моноамінодикарбонові амінокислоти
глутамінова кислота
аспарагінова кислота
серин
Гідроксиамінокислоти
Слайд #7
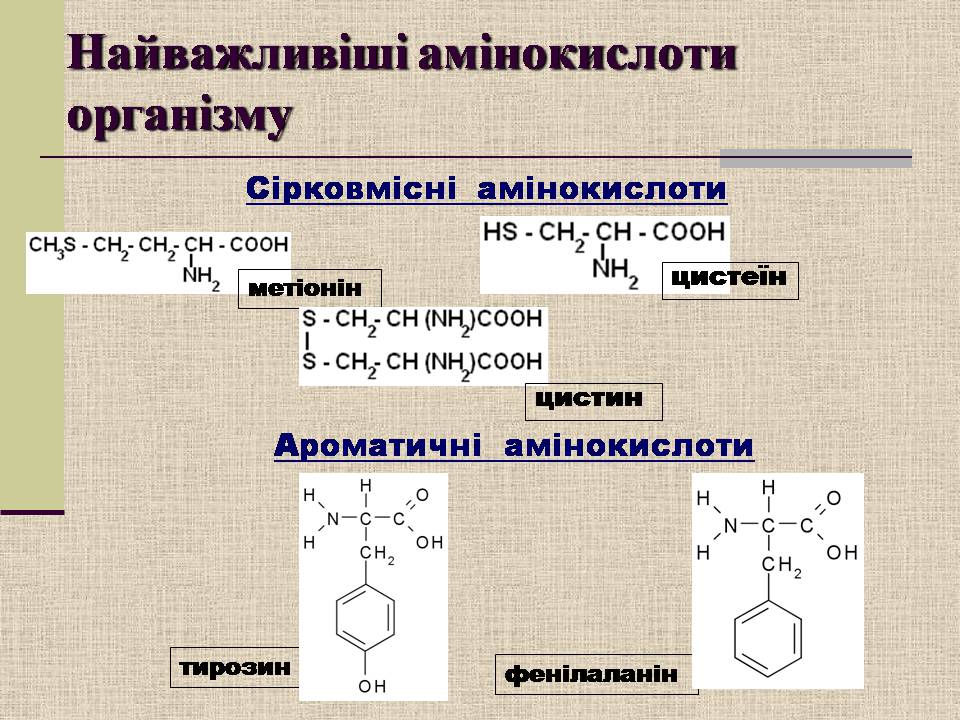
тирозин
фенілаланін
метіонін
цистин
цистеїн
Найважливіші амінокислоти організму
Сірковмісні амінокислоти
Ароматичні амінокислоти
фенілаланін
метіонін
цистин
цистеїн
Найважливіші амінокислоти організму
Сірковмісні амінокислоти
Ароматичні амінокислоти
Слайд #8
Найважливіші амінокислоти організму
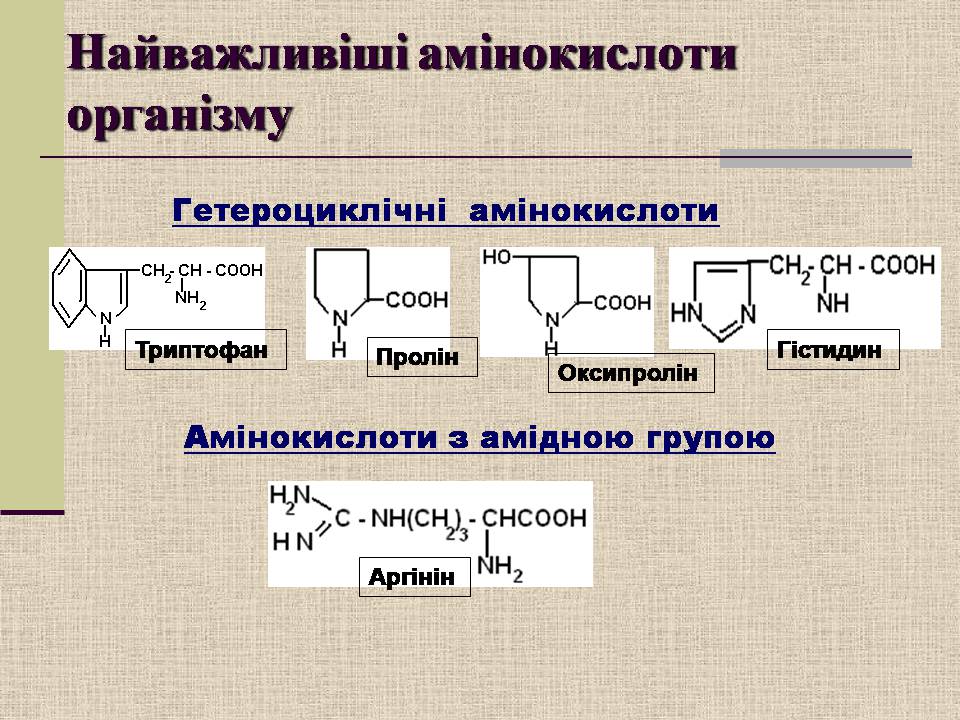
Гетероциклічні амінокислоти
Триптофан
Пролін
Оксипролін
Гістидин
Амінокислоти з амідною групою
Аргінін
Гетероциклічні амінокислоти
Триптофан
Пролін
Оксипролін
Гістидин
Амінокислоти з амідною групою
Аргінін
Слайд #9
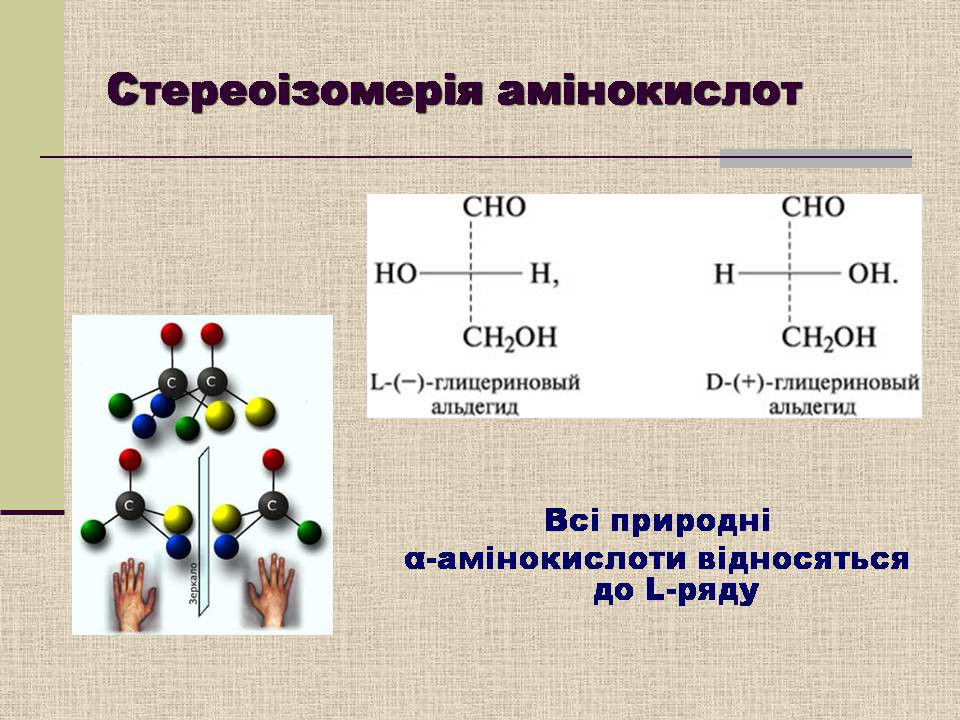
Стереоізомерія амінокислот
Всі природні
α-амінокислоти відносяться до L-ряду
Всі природні
α-амінокислоти відносяться до L-ряду
Слайд #10
Кислотно-основні властивості амінокислот
Амінокислоти проявляють амфотерні властивості оскільки вміщують як основну групу -NH2, так і кислотну групу -СООН. Амфотерність амінокислот проявляється, наприклад, при утворенні внутрішніх солей, так званих біполярних іонів
H2N-CH2-COOH → H3N+-CH2-COO-
Амінокислоти реагують як з лугами, так і з кислотами
Амінокислоти проявляють амфотерні властивості оскільки вміщують як основну групу -NH2, так і кислотну групу -СООН. Амфотерність амінокислот проявляється, наприклад, при утворенні внутрішніх солей, так званих біполярних іонів
H2N-CH2-COOH → H3N+-CH2-COO-
Амінокислоти реагують як з лугами, так і з кислотами

Слайд #11
Реакції поліконденсації
α-Амінокислоти при взаємодії між собою утворюють аміди, які називають пептидами. Зв'язок називається
пептидним
При взаємодії гліцину і аланіну утворюється дипептид гліцилаланін
α-Амінокислоти при взаємодії між собою утворюють аміди, які називають пептидами. Зв'язок називається
пептидним
При взаємодії гліцину і аланіну утворюється дипептид гліцилаланін

Слайд #12
Фізико-хімічні властивості амінокислот
Ізоелектрична точка – значення
рН, при якому білок набуває
нульового заряду і випадає в осад
Денатурація – незворотнє осадження білків
під впливом:
Високої температури
Високого тиску
Концентрованих мінеральних кислот
Алкалоїдних реактивів
Висолювання – зворотнє осадження білків, яке відбувається
під впливом солей лужних та лужно-земельних металів
Ізоелектрична точка – значення
рН, при якому білок набуває
нульового заряду і випадає в осад
Денатурація – незворотнє осадження білків
під впливом:
Високої температури
Високого тиску
Концентрованих мінеральних кислот
Алкалоїдних реактивів
Висолювання – зворотнє осадження білків, яке відбувається
під впливом солей лужних та лужно-земельних металів

Слайд #13
Хімічні властивості амінокислот
І. За карбоксильною групою:
Утворення солей
Утворення ефірів
Утворення галогенангідридів
Декарбоксилювання
ІІ. За аміногрупою:
Утворення N-ацилпохідних
Дезамінування: окисне, відновне, гідролітичне та внутрішньомолекулярне
Утворення основ Шиффа (заміщені іміни)
Взаємодія з 2,4-динітрофторбензолом (реакція Сенгера)
Взаємодія з фенілізотіоціанатом (реакція Едмана)
І. За карбоксильною групою:
Утворення солей
Утворення ефірів
Утворення галогенангідридів
Декарбоксилювання
ІІ. За аміногрупою:
Утворення N-ацилпохідних
Дезамінування: окисне, відновне, гідролітичне та внутрішньомолекулярне
Утворення основ Шиффа (заміщені іміни)
Взаємодія з 2,4-динітрофторбензолом (реакція Сенгера)
Взаємодія з фенілізотіоціанатом (реакція Едмана)

Слайд #14
Якісні реакції на амінокислоти
Нінгідринова – реакція на α-амінокислоти (синьо-фіолетове забарвлення)
2. Ксантопротеїнова – реакція на ароматичні амінокислоти (жовто-оранжове забарвлення)
3. Реакція Адамкевича – на триптофан (червоно-фіолетове забарвлення)
4. Реакція Фоля – на сірковмісні амінокислоти (утворення чорного осаду)
5. Біуретова реакція – реакція на пептидні зв'язки (синьо-фіолетове забарвлення)
Нінгідринова – реакція на α-амінокислоти (синьо-фіолетове забарвлення)
2. Ксантопротеїнова – реакція на ароматичні амінокислоти (жовто-оранжове забарвлення)
3. Реакція Адамкевича – на триптофан (червоно-фіолетове забарвлення)
4. Реакція Фоля – на сірковмісні амінокислоти (утворення чорного осаду)
5. Біуретова реакція – реакція на пептидні зв'язки (синьо-фіолетове забарвлення)

Слайд #15
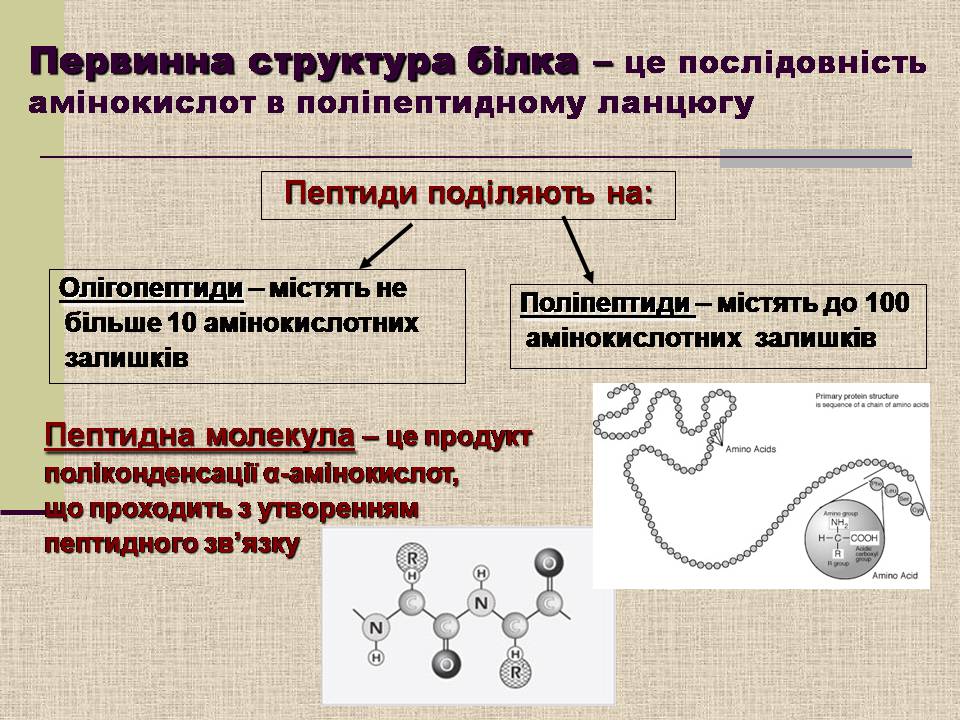
Первинна структура білка – це послідовність амінокислот в поліпептидному ланцюгу
Пептиди поділяють на:
Олігопептиди – містять не
більше 10 амінокислотних
залишків
Поліпептиди – містять до 100
амінокислотних залишків
Пептидна молекула – це продукт
поліконденсації α-амінокислот,
що проходить з утворенням
пептидного зв'язку
Пептиди поділяють на:
Олігопептиди – містять не
більше 10 амінокислотних
залишків
Поліпептиди – містять до 100
амінокислотних залишків
Пептидна молекула – це продукт
поліконденсації α-амінокислот,
що проходить з утворенням
пептидного зв'язку
Слайд #16
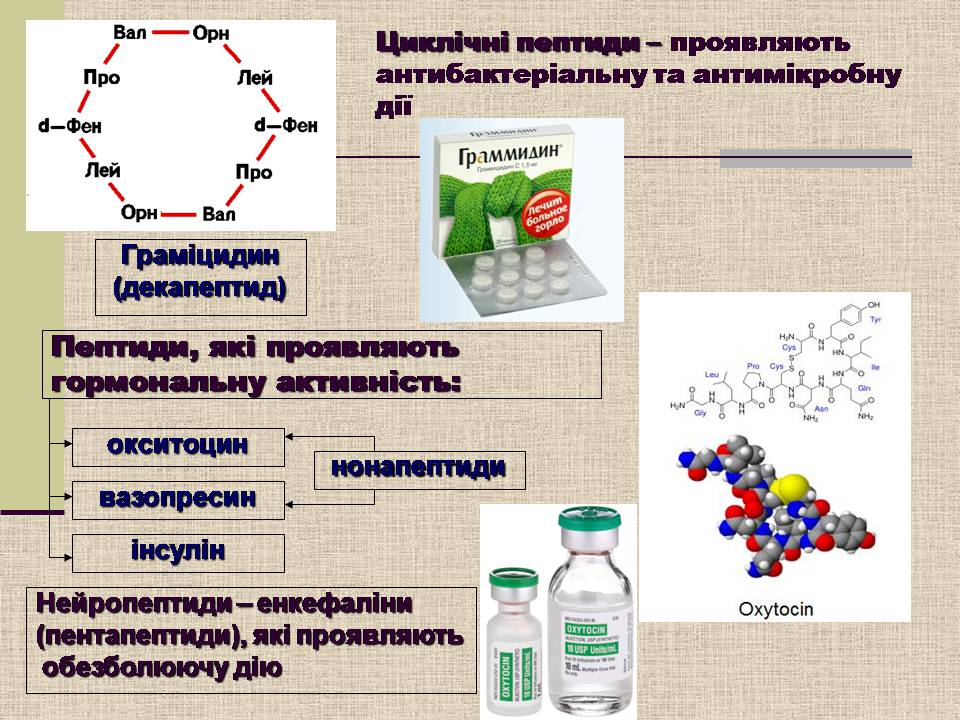
Циклічні пептиди – проявляють антибактеріальну та антимікробну дії
Граміцидин
(декапептид)
Пептиди, які проявляють
гормональну активність:
окситоцин
вазопресин
інсулін
нонапептиди
Нейропептиди – енкефаліни
(пентапептиди), які проявляють
обезболюючу дію
Граміцидин
(декапептид)
Пептиди, які проявляють
гормональну активність:
окситоцин
вазопресин
інсулін
нонапептиди
Нейропептиди – енкефаліни
(пентапептиди), які проявляють
обезболюючу дію
Слайд #17
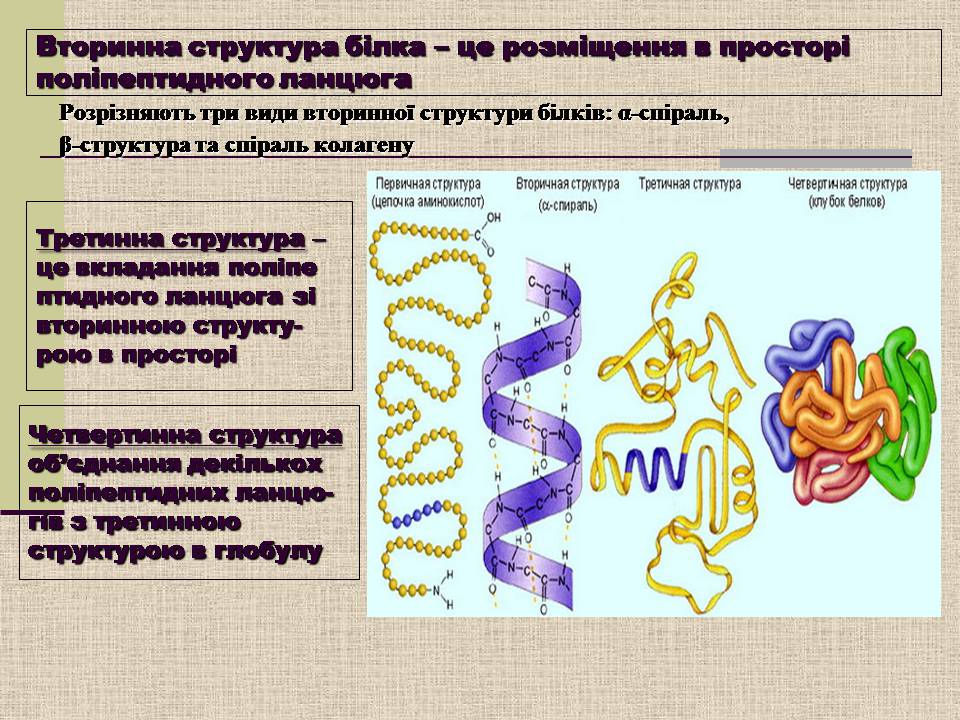
Вторинна структура білка – це розміщення в просторі поліпептидного ланцюга
Розрізняють три види вторинної структури білків: α-спіраль,
β-структура та спіраль колагену
Третинна структура – це вкладання поліпептидного ланцюга зі вторинною структу-рою в просторі
Четвертинна структура об'єднання декількох поліпептидних ланцю-гів з третинною структурою в глобулу
Розрізняють три види вторинної структури білків: α-спіраль,
β-структура та спіраль колагену
Третинна структура – це вкладання поліпептидного ланцюга зі вторинною структу-рою в просторі
Четвертинна структура об'єднання декількох поліпептидних ланцю-гів з третинною структурою в глобулу
Слайд #18
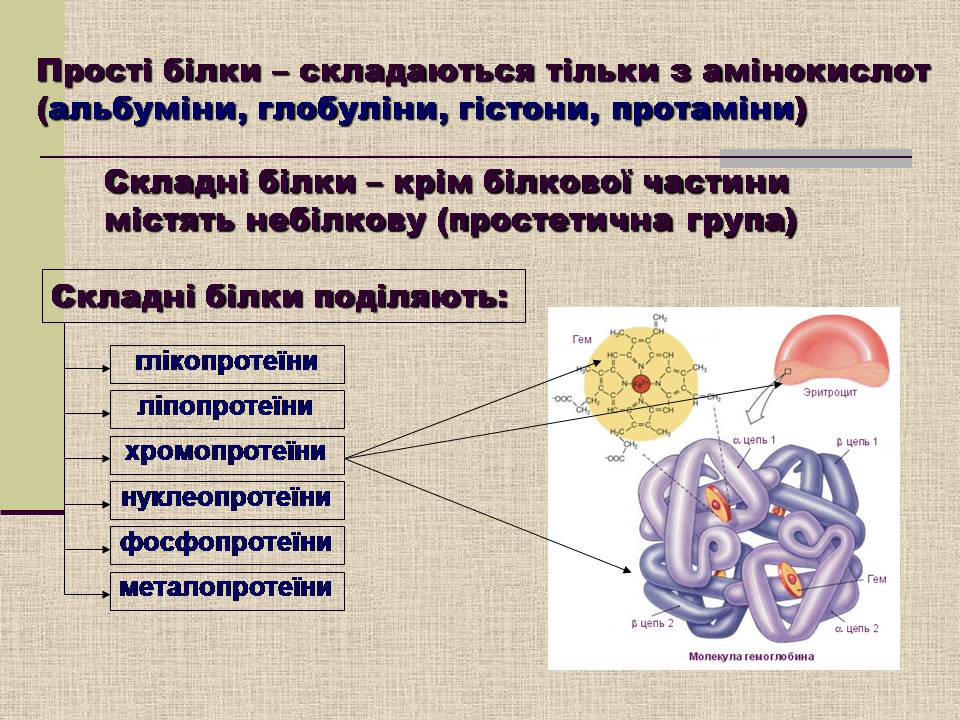
Прості білки – складаються тільки з амінокислот (альбуміни, глобуліни, гістони, протаміни)
Складні білки – крім білкової частини містять небілкову (простетична група)
Складні білки поділяють:
глікопротеїни
ліпопротеїни
хромопротеїни
нуклеопротеїни
фосфопротеїни
металопротеїни
Складні білки – крім білкової частини містять небілкову (простетична група)
Складні білки поділяють:
глікопротеїни
ліпопротеїни
хромопротеїни
нуклеопротеїни
фосфопротеїни
металопротеїни