- Головна
- Готові шкільні презентації
- Презентація на тему «Кислоти» (варіант 3)
Презентація на тему «Кислоти» (варіант 3)
212
Слайд #1

Слайд #2
Тема уроку:
КИСЛОТИ
КИСЛОТИ

Слайд #3
Мета уроку:
Знати:
визначення,склад, класифікацію,формули,
номенклатуру ,фізичні та хімічні властивості
кислот
Вміти:
Визначати кислоти, складати їх формули
Записувати рівняння хімічних властивостей
Развивати:
Увагу,пам'ять,абстрактне мислення
Знати:
визначення,склад, класифікацію,формули,
номенклатуру ,фізичні та хімічні властивості
кислот
Вміти:
Визначати кислоти, складати їх формули
Записувати рівняння хімічних властивостей
Развивати:
Увагу,пам'ять,абстрактне мислення

Слайд #4
Цілі:
Склад,класифікація кислот
Номенклатура,формули
Фізичні властивості
Хімічні властивості
Добування
Застосування
Дія на організм.Поводження з кислотами.
Склад,класифікація кислот
Номенклатура,формули
Фізичні властивості
Хімічні властивості
Добування
Застосування
Дія на організм.Поводження з кислотами.

Слайд #5
Актуалізація знань
Тест- тренажер з теми «Основи»
Тест- тренажер з теми «Основи»

Слайд #6
1.Вибрати формулу лугу
1
2
3
4
Fe(OH)2
KOH
Ba(OH)2
Fe(OH)3
1
2
3
4
Fe(OH)2
KOH
Ba(OH)2
Fe(OH)3

Слайд #7
2.Вибрати формулу основи
1
2
3
4
MnO2
H2O
NaOH
HCl
1
2
3
4
MnO2
H2O
NaOH
HCl

Слайд #8
3.Яка формула написана вірно?
1
2
3
4
Cu(OH)2
KOH2
BaOH
MgOH
1
2
3
4
Cu(OH)2
KOH2
BaOH
MgOH

Слайд #9
4. Яку основу утворює оксид MgO?
1
2
3
4
MgOH
Mg(OH)2
MgOH2
Mg(OH)3
1
2
3
4
MgOH
Mg(OH)2
MgOH2
Mg(OH)3

Слайд #10
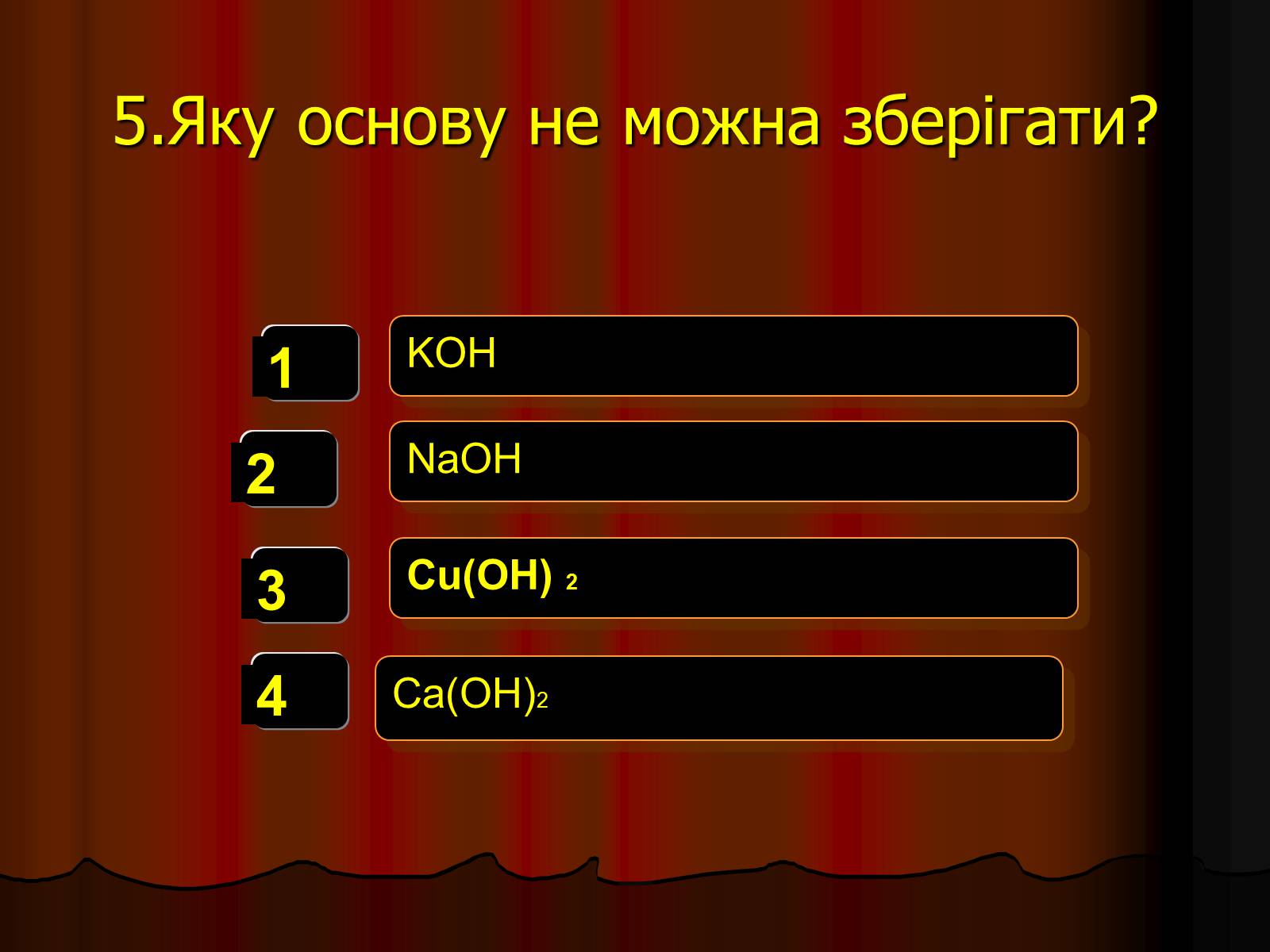
5.Яку основу не можна зберігати?
1
2
3
4
KOH
NaOH
Cu(OH) 2
Ca(OH)2
1
2
3
4
KOH
NaOH
Cu(OH) 2
Ca(OH)2
Слайд #11
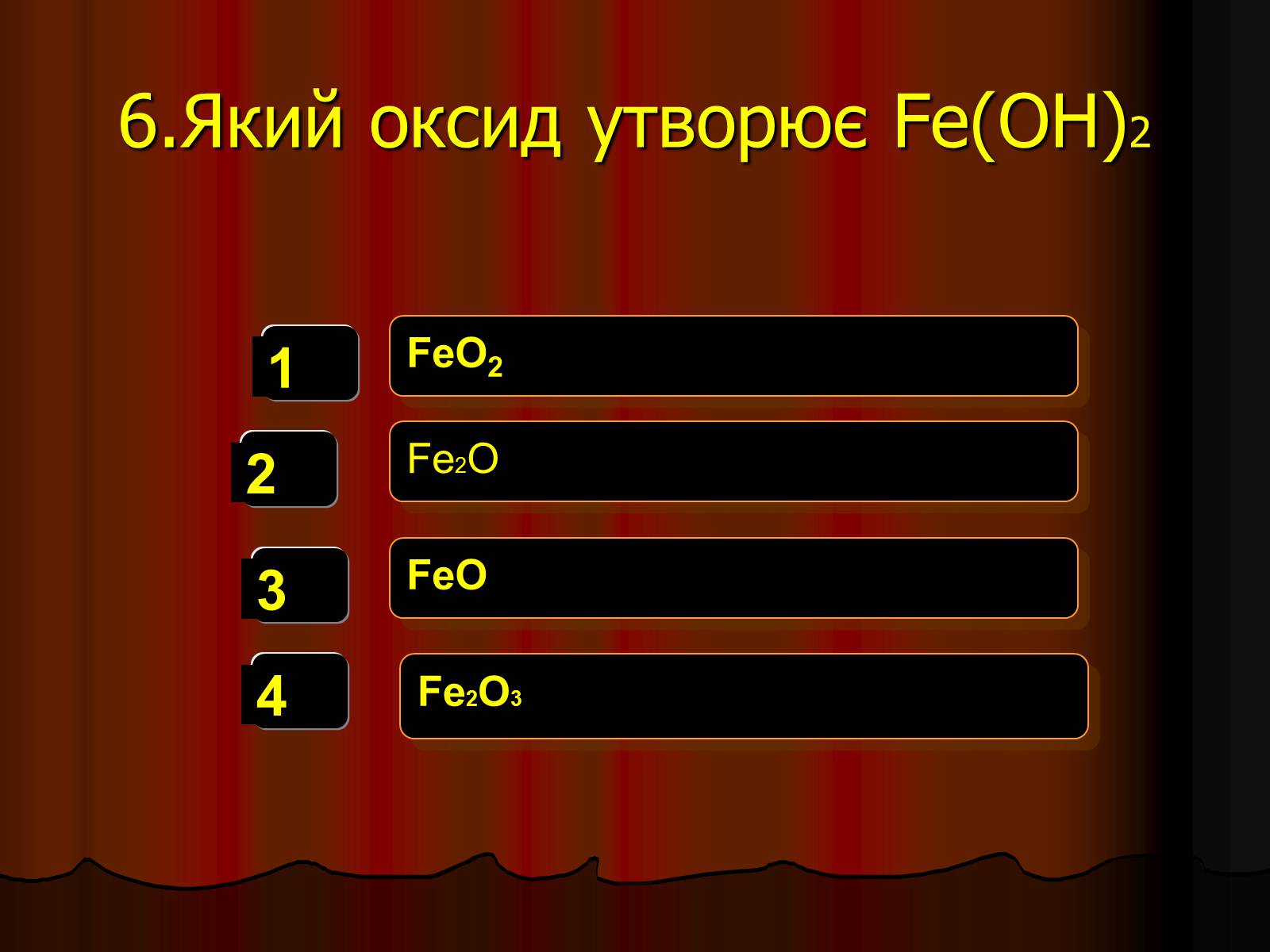
6.Який оксид утворює Fe(OH)2
1
2
3
4
FeO2
Fe2O
FeO
Fe2O3
1
2
3
4
FeO2
Fe2O
FeO
Fe2O3
Слайд #12
7.Що таке “Їдкий натр”
1
2
3
4
NaO
Na2O
NaOH
Na(OH)2
)
1
2
3
4
NaO
Na2O
NaOH
Na(OH)2
)

Слайд #13
8.Де застосовується Ca(OH)2 ?
1
2
3
4
Як миючий засіб
В будівництві
В металургії
У виробництві ліків
1
2
3
4
Як миючий засіб
В будівництві
В металургії
У виробництві ліків

Слайд #14
9.Чим луги відрізняються від основ?
1
2
3
4
їдкі
Роблять опіки
мильні
Не розчинні
1
2
3
4
їдкі
Роблять опіки
мильні
Не розчинні

Слайд #15
10.Чого не повинно бути у миючих засобах?
1
2
3
4
лугів
кислот
фосфатів
нітратів
1
2
3
4
лугів
кислот
фосфатів
нітратів

Слайд #16
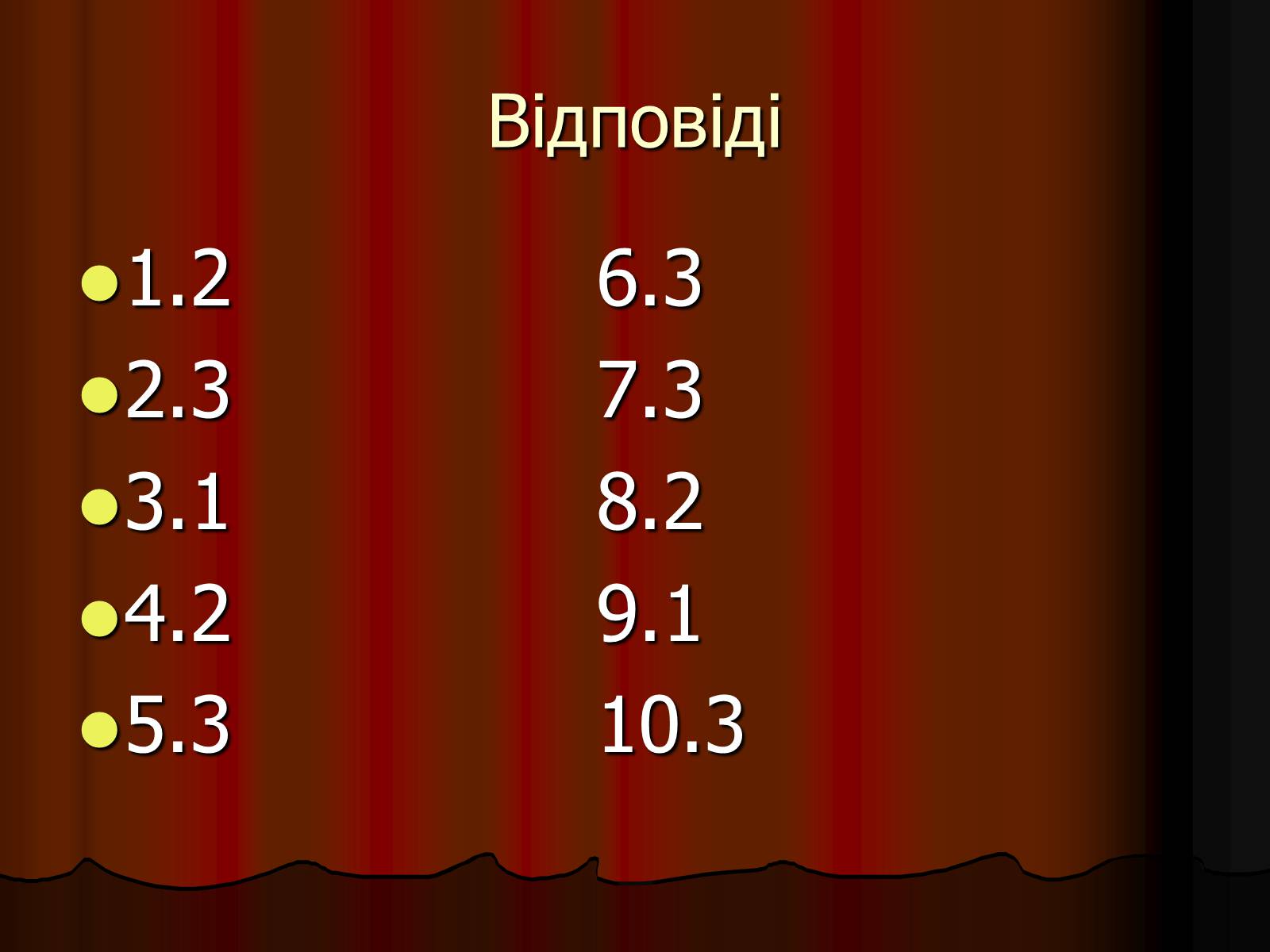
Відповіді
1.2 6.3
2.3 7.3
3.1 8.2
4.2 9.1
5.3 10.3
1.2 6.3
2.3 7.3
3.1 8.2
4.2 9.1
5.3 10.3
Слайд #17
Кислоти
- це складні речовини, які складаються з одного або декількох атомів гідрогену та кислотного залишку
HxR
- це складні речовини, які складаються з одного або декількох атомів гідрогену та кислотного залишку
HxR

Слайд #18
Кислоти утворюються з кислотних оксидів.
НеМеО +вода = кислота
НеМеО +вода = кислота

Слайд #19
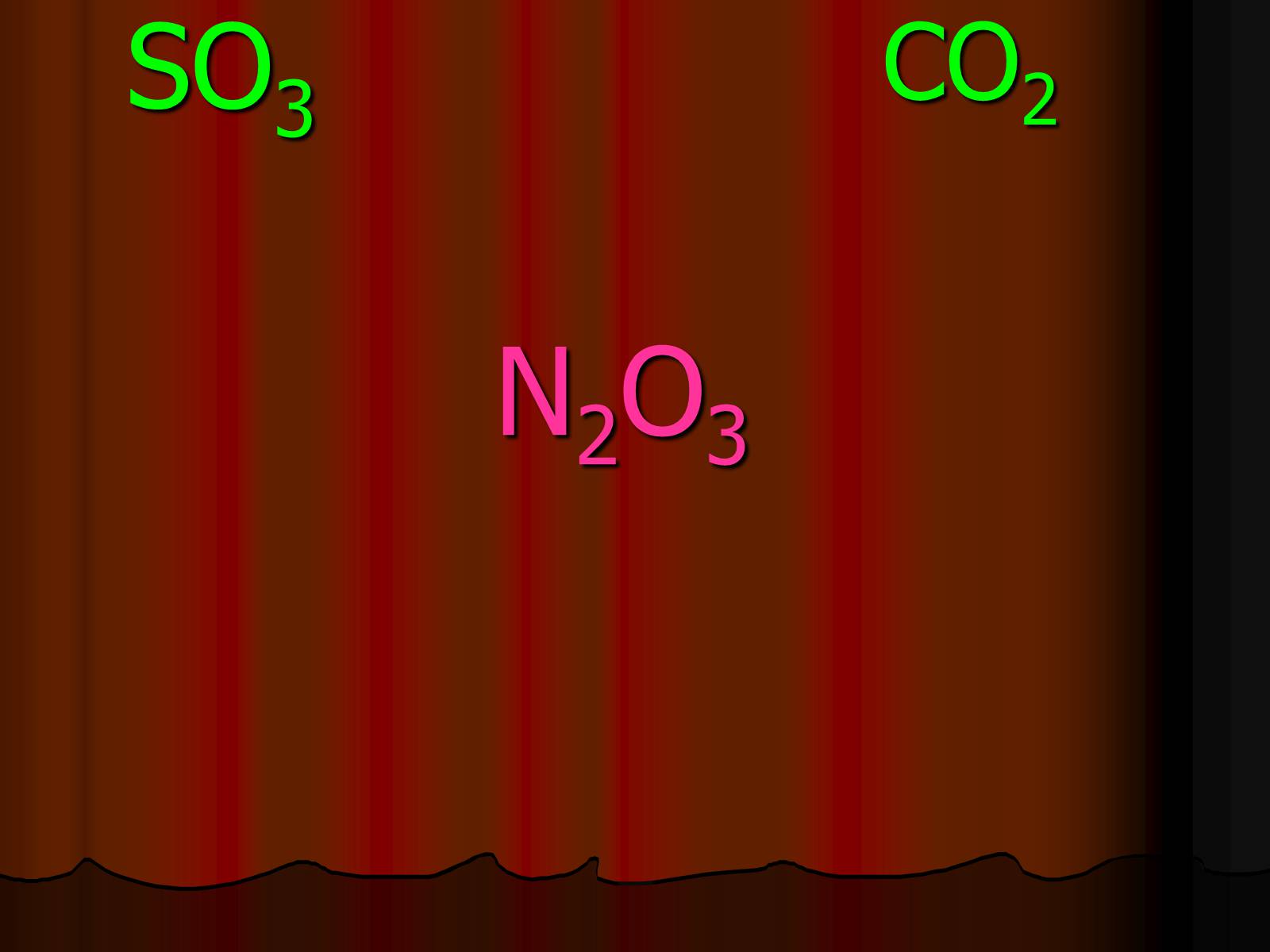
N2O3
SO3
CO2
SO3
CO2
Слайд #20
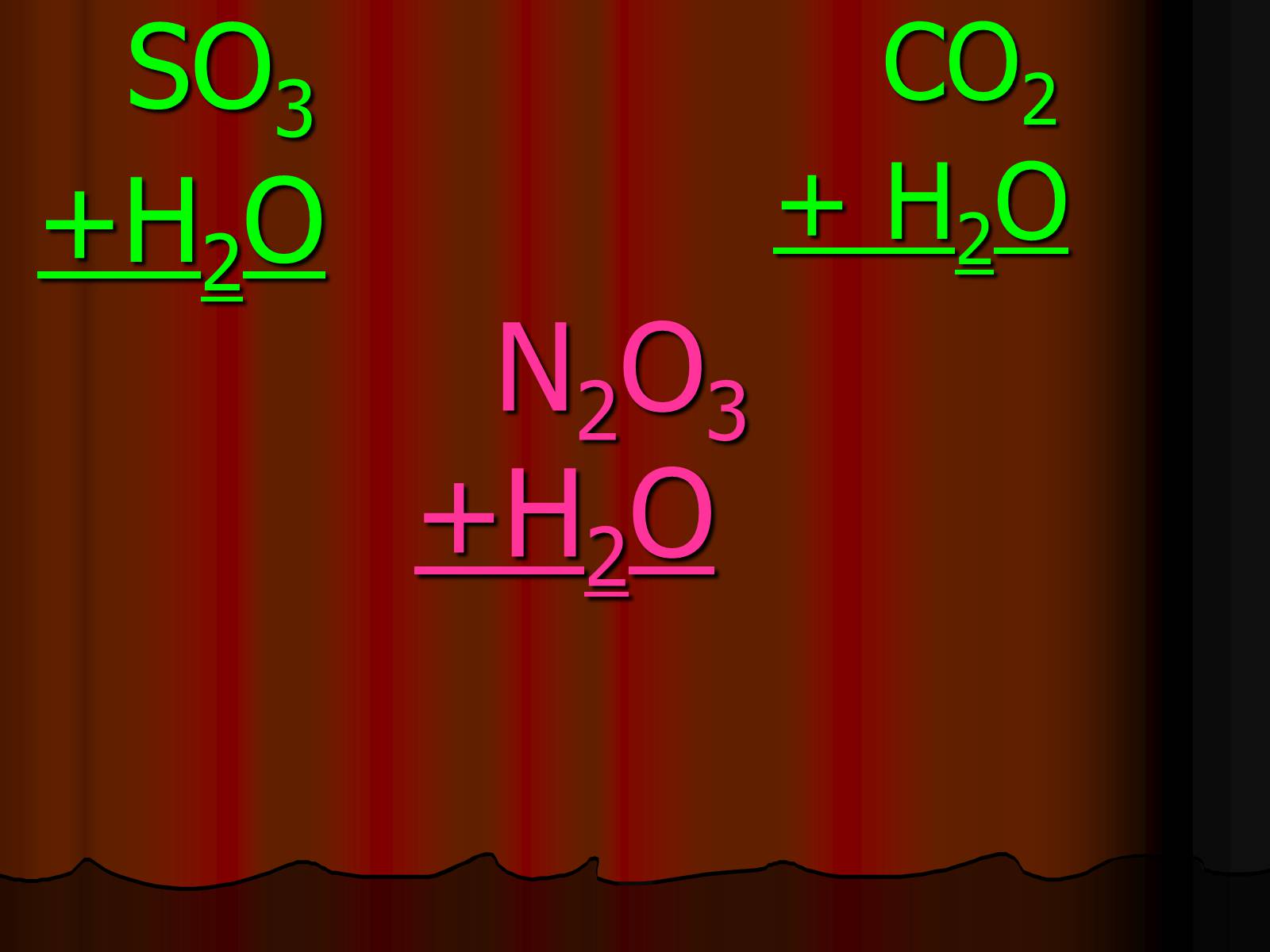
N2O3+H2O
SO3
+H2O
CO2
+ H2O
SO3
+H2O
CO2
+ H2O
Слайд #21
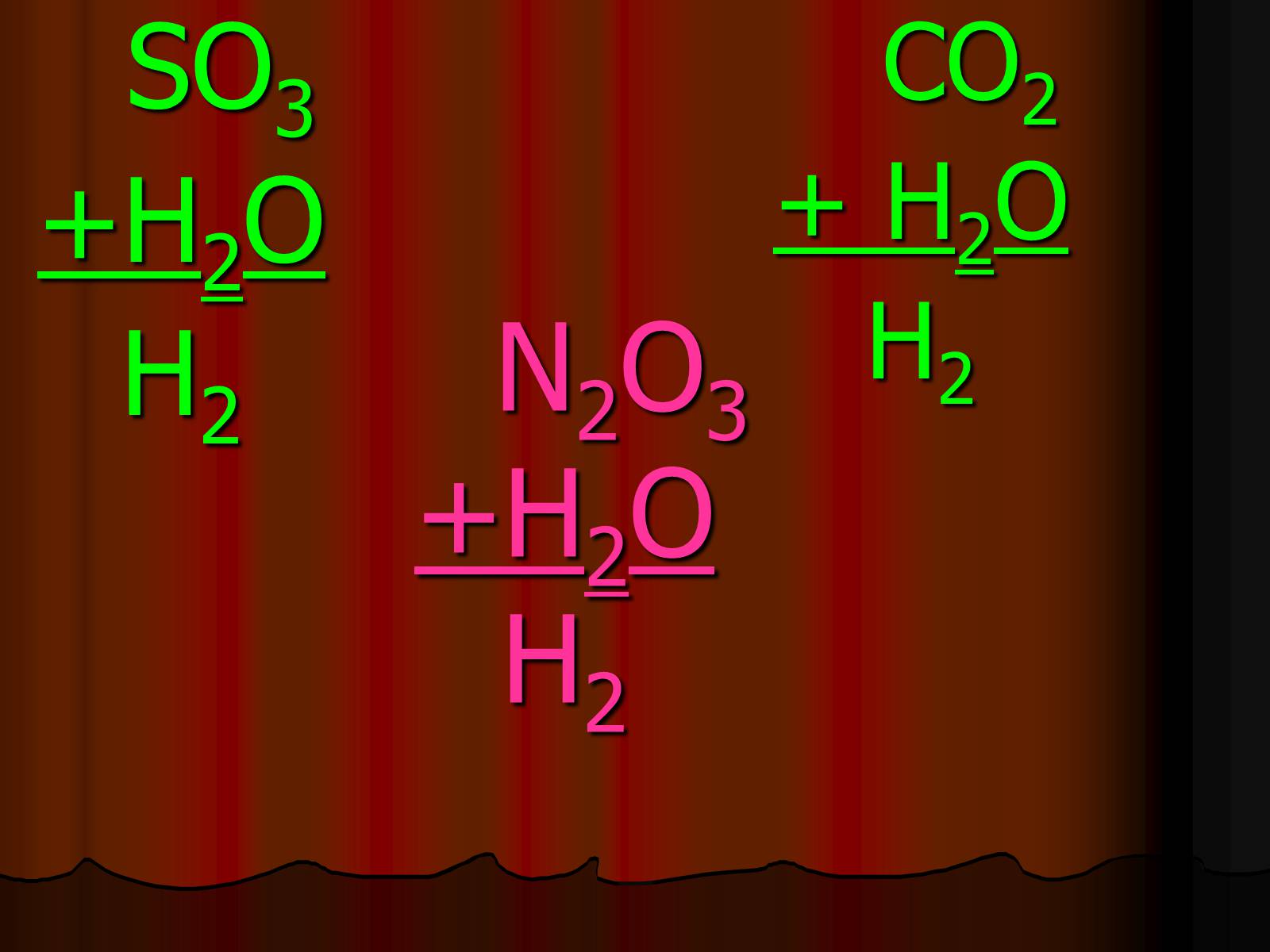
N2O3+H2OH2
SO3
+H2O
H2
CO2
+ H2O
H2
SO3
+H2O
H2
CO2
+ H2O
H2
Слайд #22
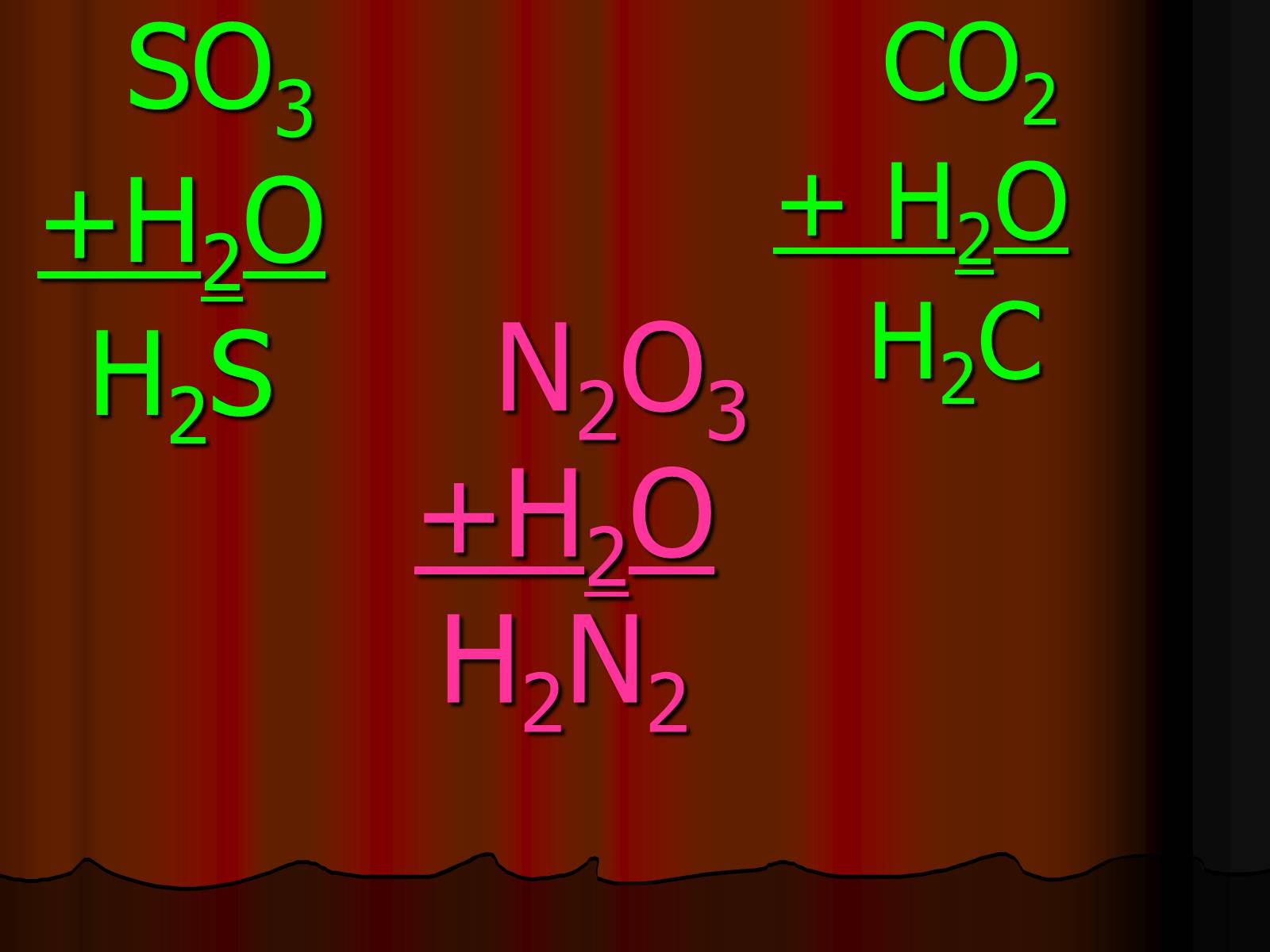
N2O3+H2OH2N2
SO3
+H2O
H2S
CO2
+ H2O
H2C
SO3
+H2O
H2S
CO2
+ H2O
H2C
Слайд #23
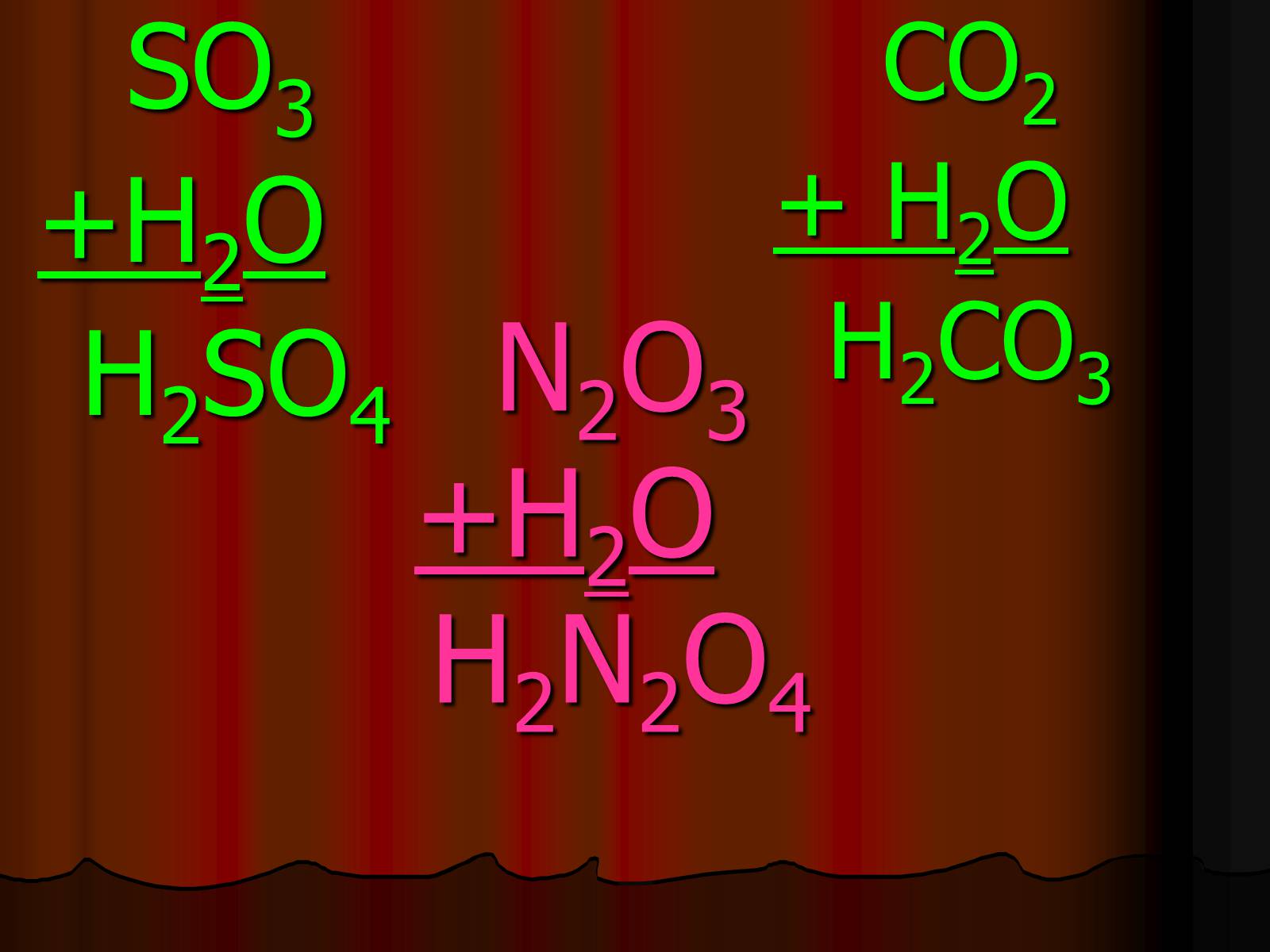
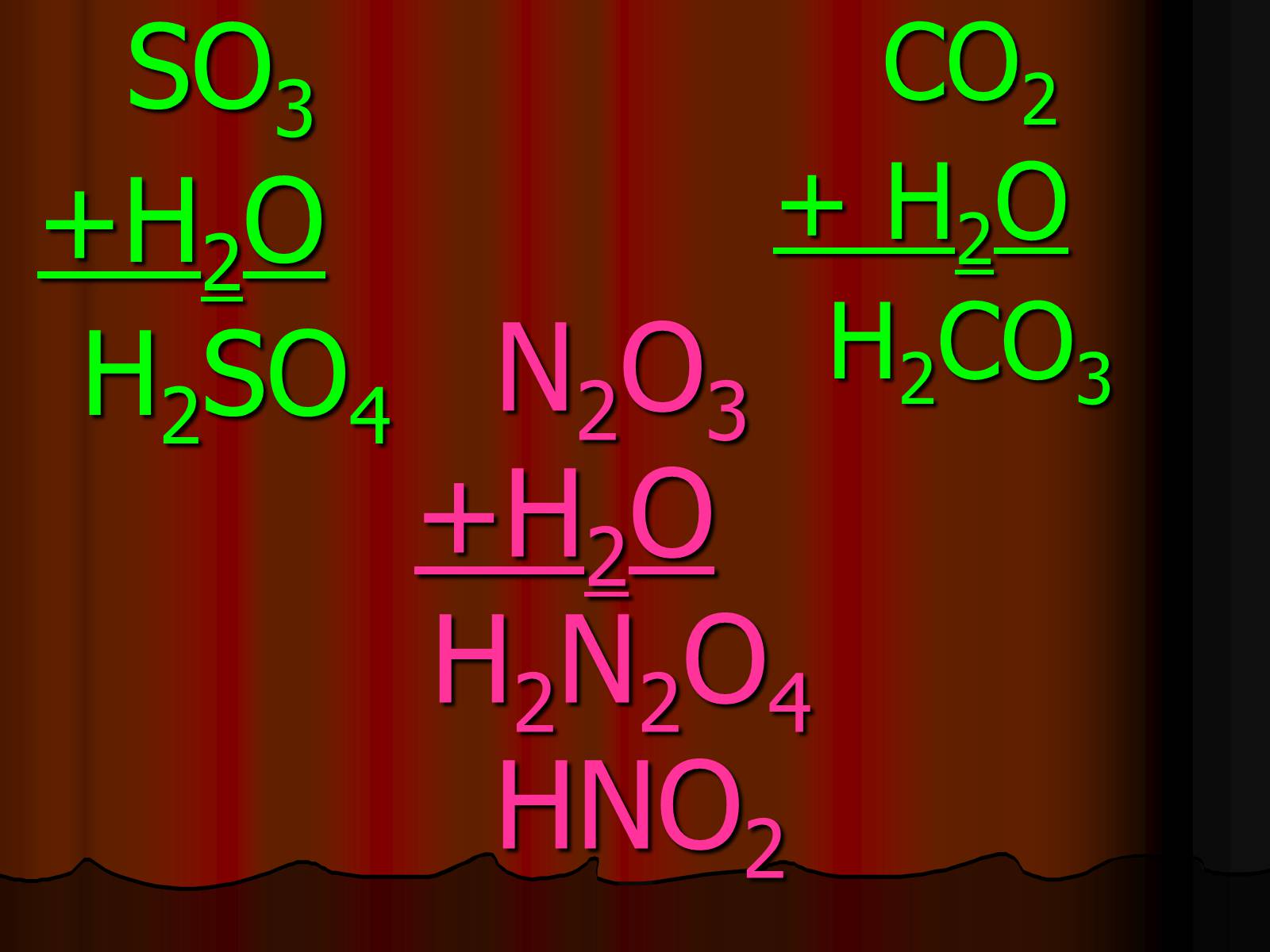
N2O3+H2O H2N2O4
SO3
+H2O
H2SO4
CO2
+ H2O
H2CO3
SO3
+H2O
H2SO4
CO2
+ H2O
H2CO3
Слайд #24
N2O3+H2O H2N2O4 HNO2
SO3
+H2O
H2SO4
CO2
+ H2O
H2CO3
SO3
+H2O
H2SO4
CO2
+ H2O
H2CO3
Слайд #25
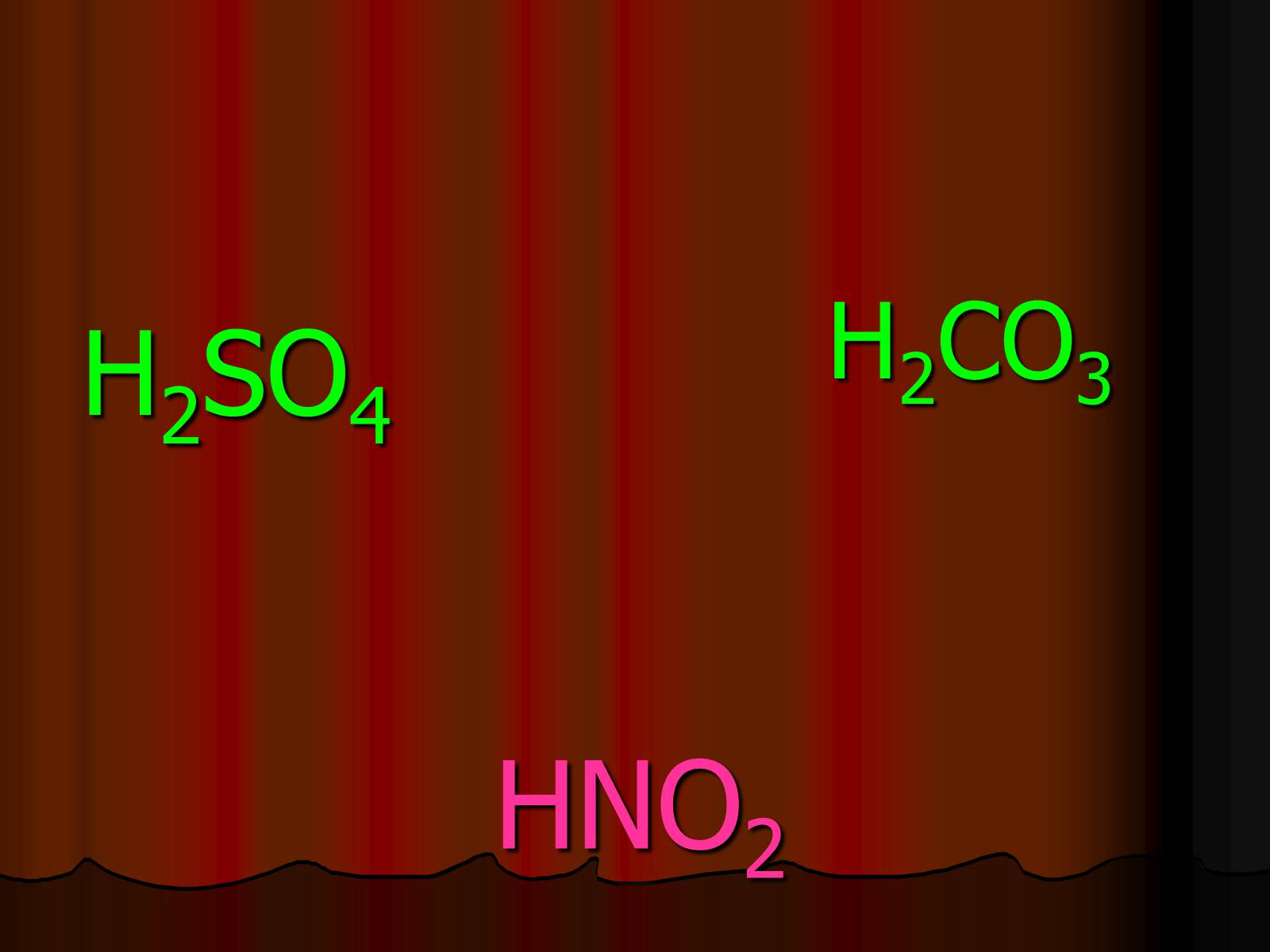
HNO2
H2SO4
H2CO3
H2SO4
H2CO3
Слайд #26
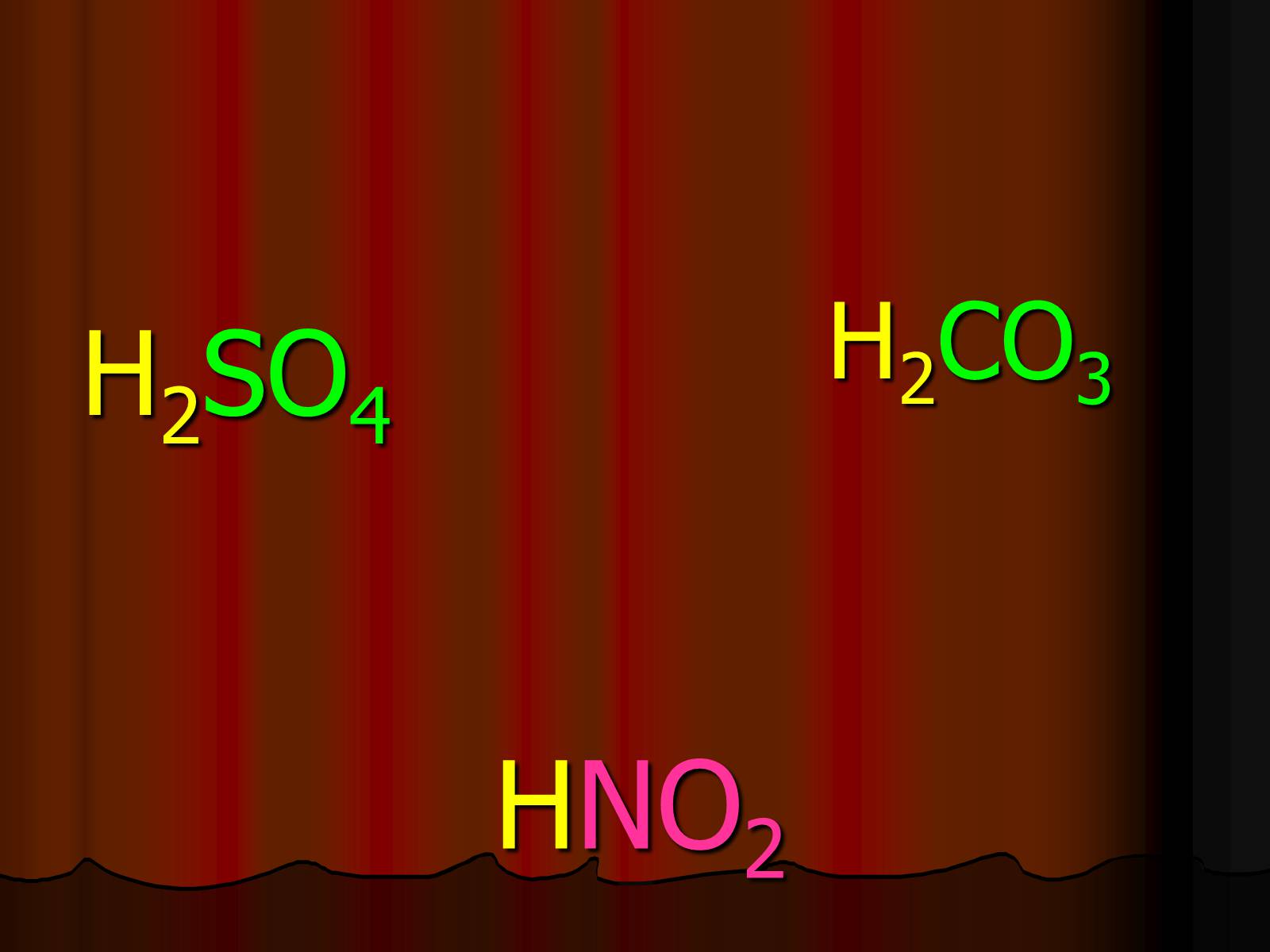
HNO2
H2SO4
H2CO3
H2SO4
H2CO3
Слайд #27
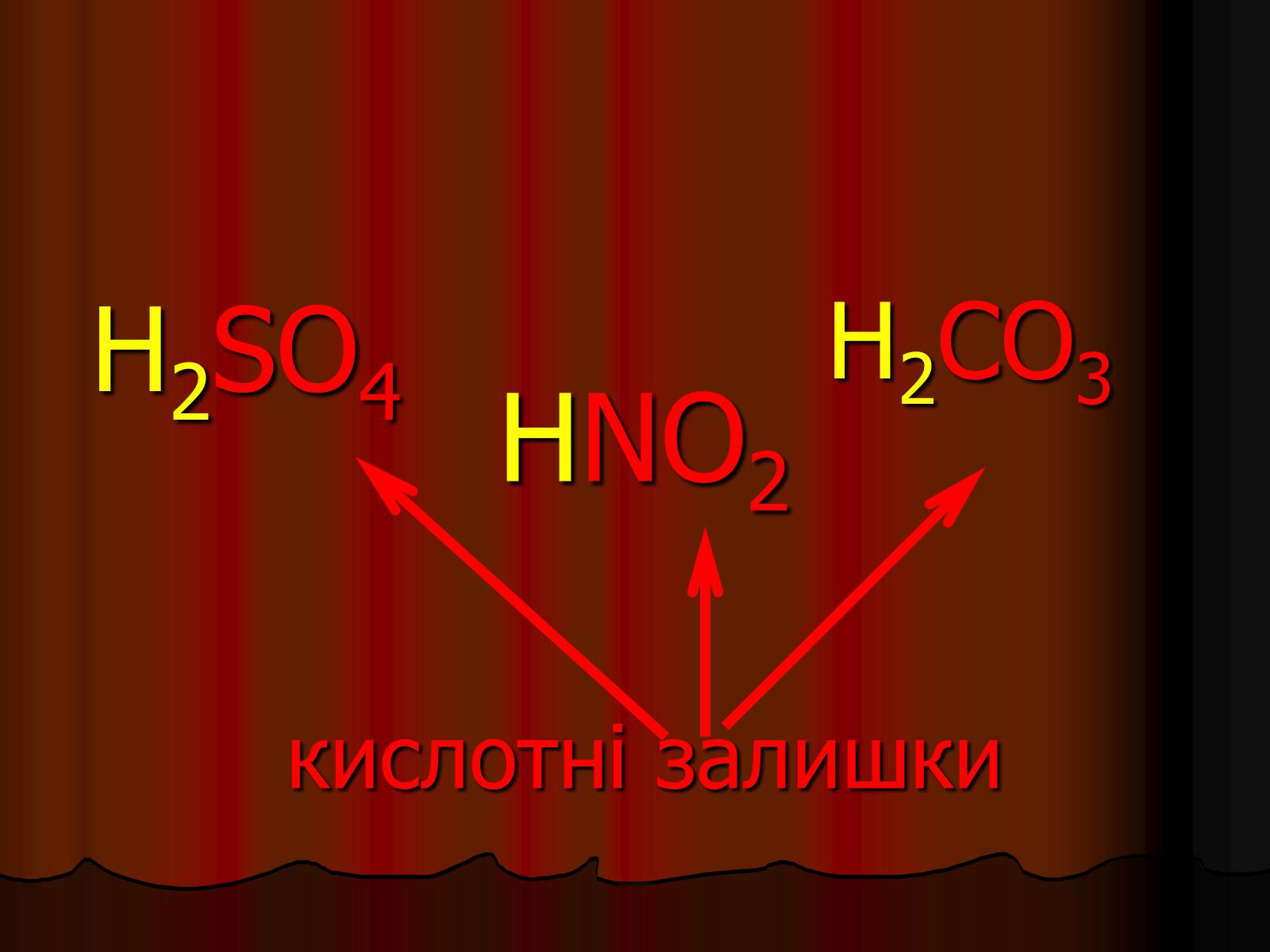
HNO2кислотні залишки
H2SO4
H2CO3
H2SO4
H2CO3
Слайд #28
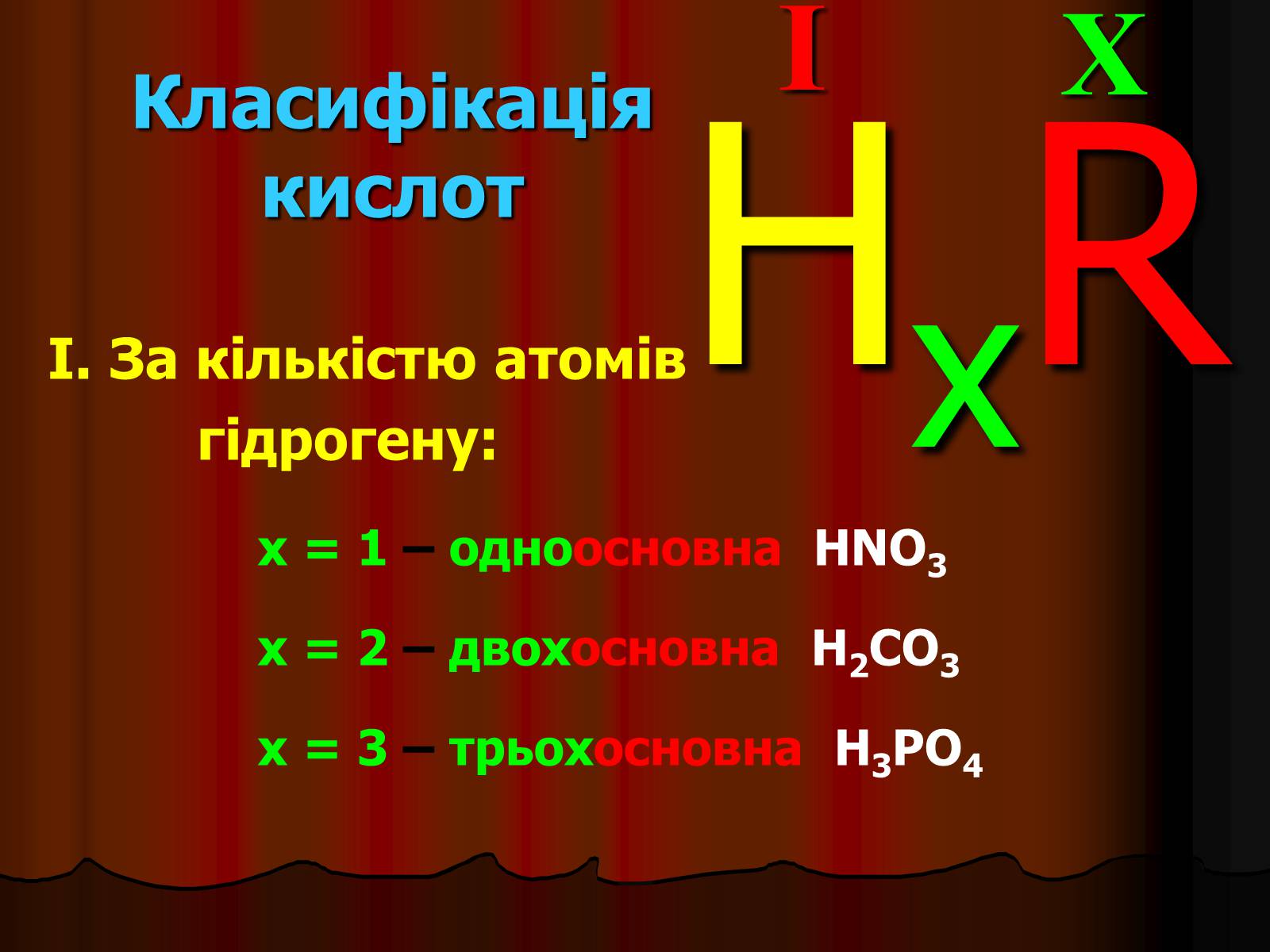
Класифікація кислот
I. За кількістю атомів
гідрогену:
X
I
HxR
x = 1 – одноосновна HNO3
x = 2 – двохосновна H2CO3
x = 3 – трьохосновна H3PO4
I. За кількістю атомів
гідрогену:
X
I
HxR
x = 1 – одноосновна HNO3
x = 2 – двохосновна H2CO3
x = 3 – трьохосновна H3PO4
Слайд #29
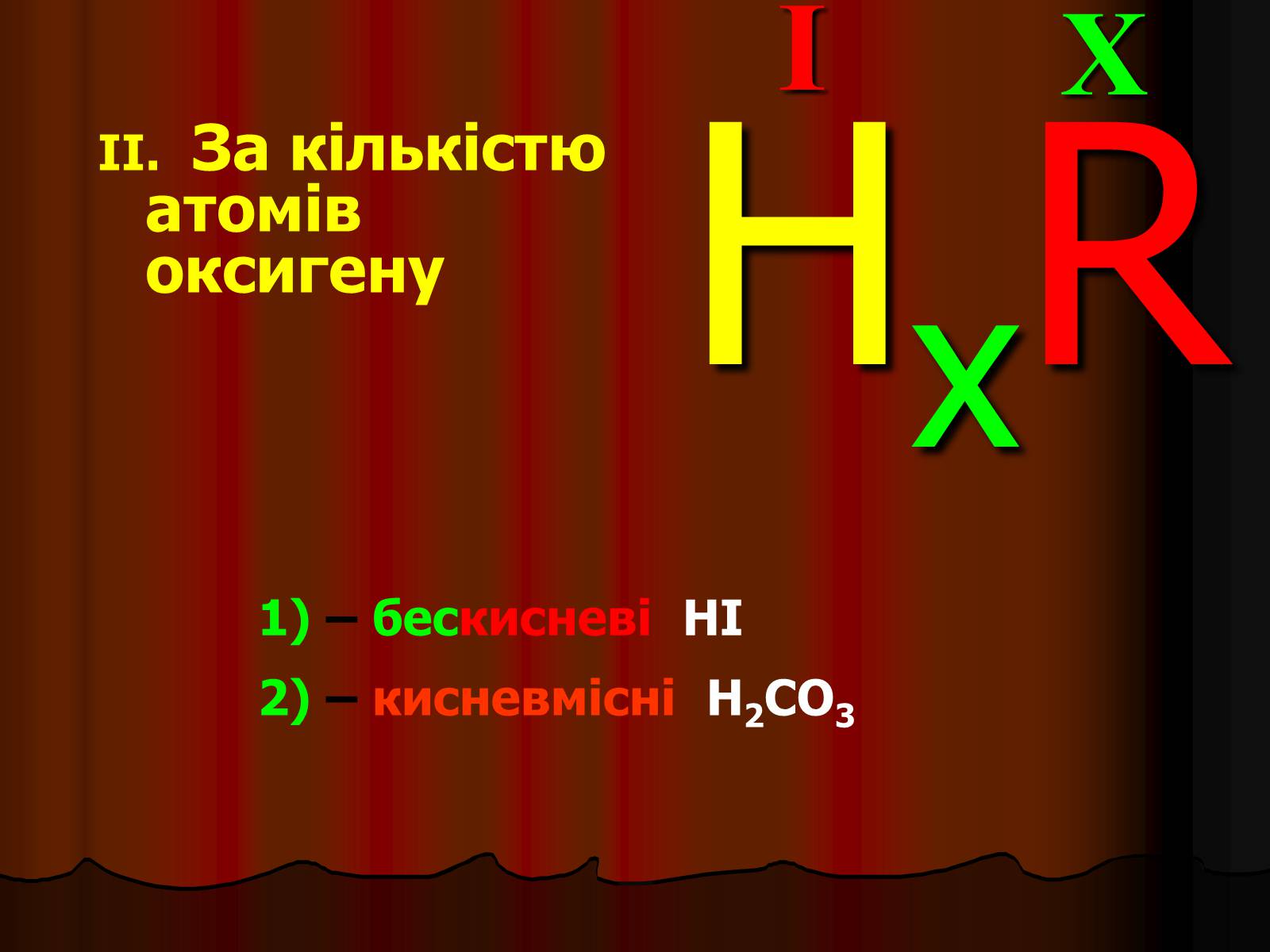
II. За кількістю атомів оксигену
X
I
HxR
1) – бескисневі HI
2) – кисневмісні H2CO3
X
I
HxR
1) – бескисневі HI
2) – кисневмісні H2CO3
Слайд #30
X
I
HxR
I
HxR

Слайд #31
Пікресліть кислотні залишки в молекулах кислот
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
_______ ________ _________ __________ _____
X
I
HxR
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
_______ ________ _________ __________ _____
X
I
HxR

Слайд #32
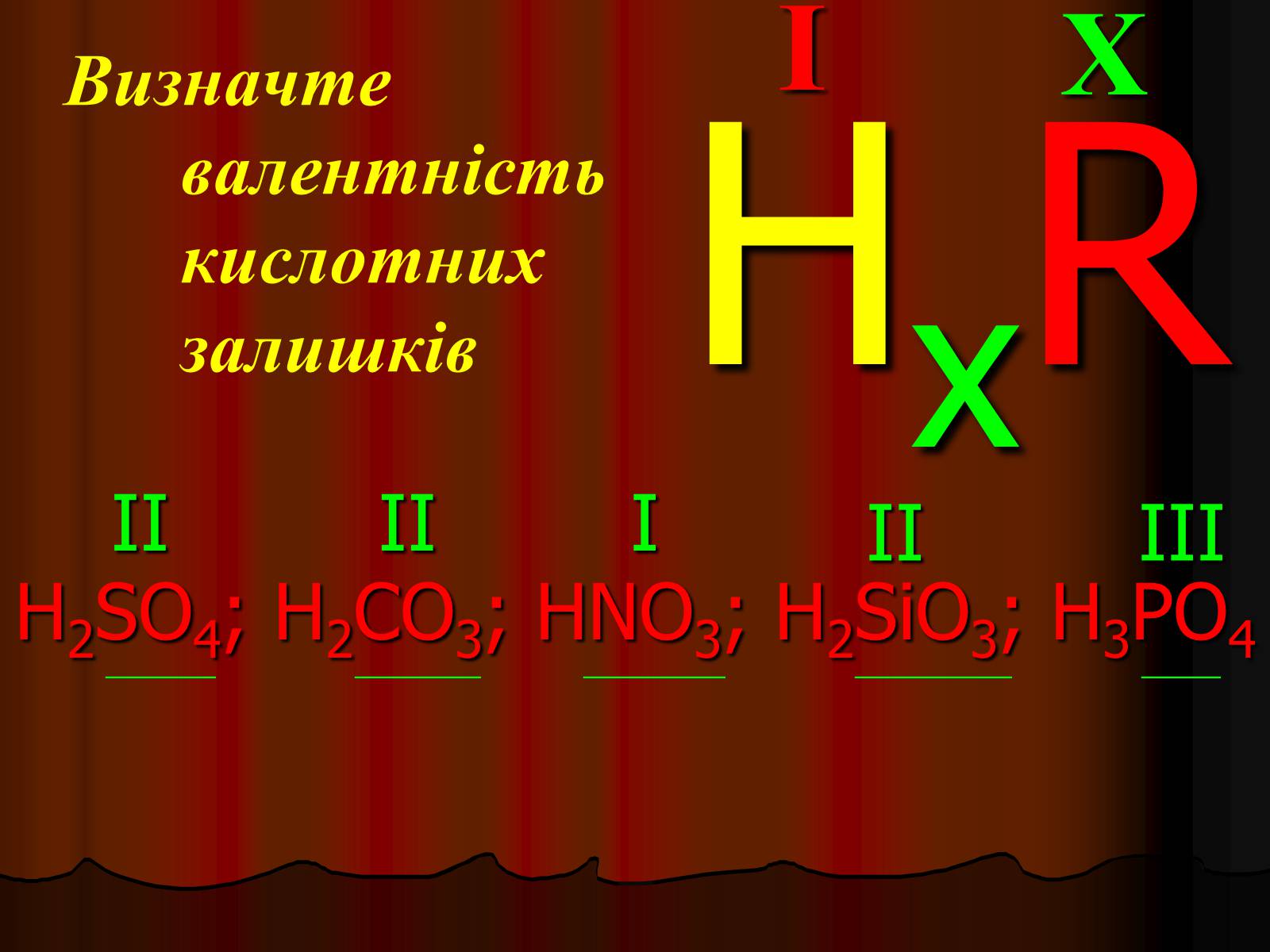
Визначте валентність кислотних залишків
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
_______ ________ _________ __________ _____
X
I
HxR
II
III
I
II
II
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
_______ ________ _________ __________ _____
X
I
HxR
II
III
I
II
II
Слайд #33
складіть формули кислот за кислотними залишками
Cl(I) →
S(II)→
PO4(III)→
SiO3(II)→
ClO4(I) →
MnO4(II) →
NO2(I)→
X
I
HxR
HCl
H2S
H3PO4
H2SiO3
HClO4
H2MnO4
HNO2
Cl(I) →
S(II)→
PO4(III)→
SiO3(II)→
ClO4(I) →
MnO4(II) →
NO2(I)→
X
I
HxR
HCl
H2S
H3PO4
H2SiO3
HClO4
H2MnO4
HNO2

Слайд #34
Завдання. Розподіліть кислоти за числом атомів гідрогену
H3PO4; HCl; H2S; HNO3; H2SO4: HBr; H2CO3; H2SO3; HClO4; H2SiO3.
H3PO4; HCl; H2S; HNO3; H2SO4: HBr; H2CO3; H2SO3; HClO4; H2SiO3.

Слайд #35
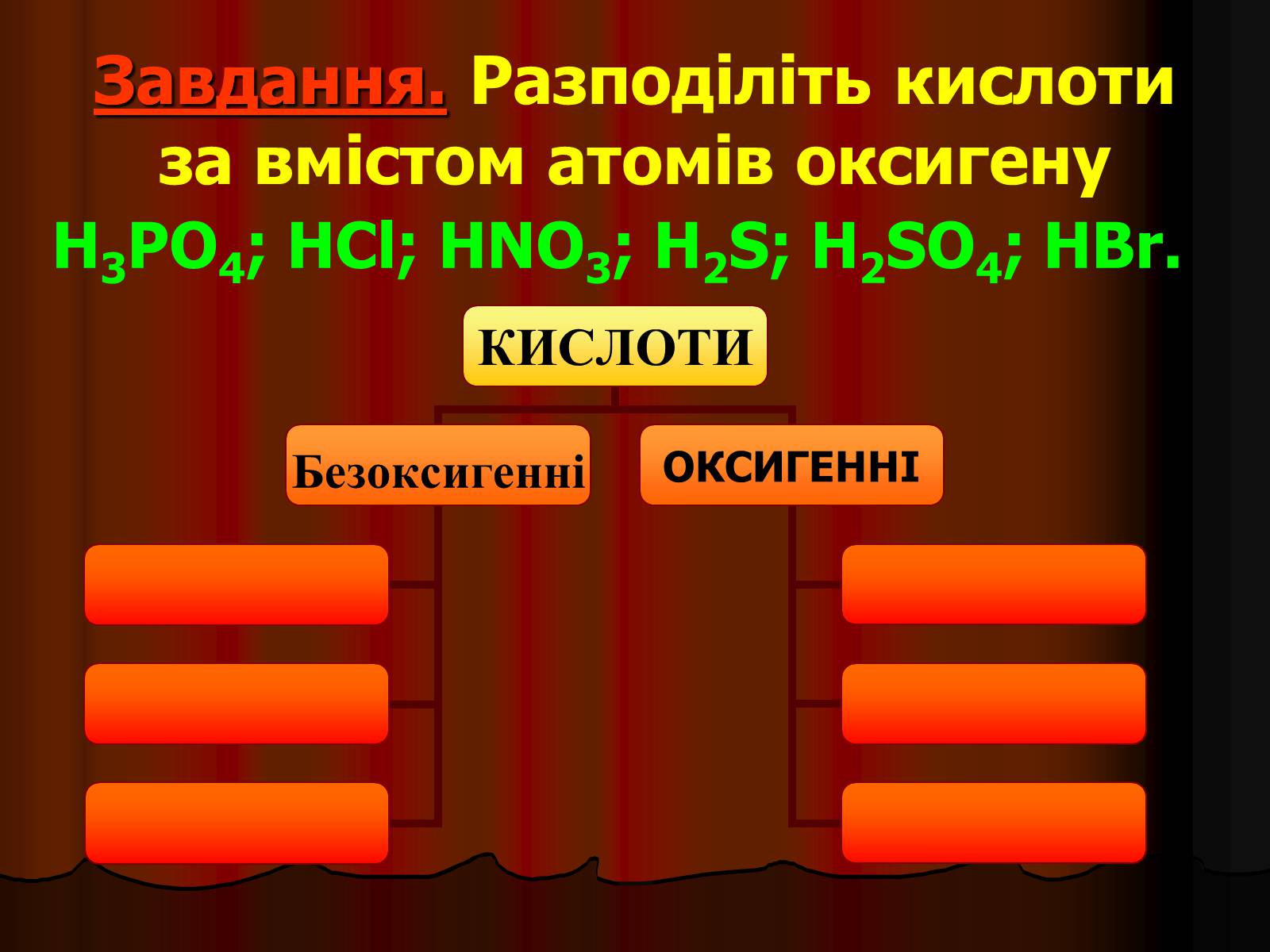
Завдання. Разподіліть кислоти за вмістом атомів оксигену
H3PO4; HCl; HNO3; H2S; H2SO4; HBr.
H3PO4; HCl; HNO3; H2S; H2SO4; HBr.
Слайд #36
ФОРМУЛА КИСЛОТИ
НАЗВА КИСЛОТИ
HF
фторидна (плавикова)
HCl
хлоридна (соляна)
HBr
бромідна
HI
йодидна
H2S
сульфідна
Назви кислот.
НАЗВА КИСЛОТИ
HF
фторидна (плавикова)
HCl
хлоридна (соляна)
HBr
бромідна
HI
йодидна
H2S
сульфідна
Назви кислот.

Слайд #37
HNO3
нітратна
H2SO3
сульфітна
H2SO4
сульфатна
H2CO3
карбонатна
H2SiO3
сілікатна
H3PO4
ортофосфатна
нітратна
H2SO3
сульфітна
H2SO4
сульфатна
H2CO3
карбонатна
H2SiO3
сілікатна
H3PO4
ортофосфатна

Слайд #38
Фізичні властивості кислот
H2 CO3 = CO2↑ +H2O – карбонатна кислота H2SO3 = SO2↑ + H2O – сульфітна кислота у вільному вигляді не існують, розпадаються на газ та воду.
HCl -хлоридна кислота H2SO4 -сульфатна кислота рідкі
HNO3 -нітратна кислота
H2SiO3 - сілікатна кислота драглиста
H2 CO3 = CO2↑ +H2O – карбонатна кислота H2SO3 = SO2↑ + H2O – сульфітна кислота у вільному вигляді не існують, розпадаються на газ та воду.
HCl -хлоридна кислота H2SO4 -сульфатна кислота рідкі
HNO3 -нітратна кислота
H2SiO3 - сілікатна кислота драглиста

Слайд #39
Хімічні властивості кислот

Слайд #40
Індикатори
речовини, які змінюють колір в залежності від середовища розчину
Лакмус
Метилоранж
Фенолфталеин
речовини, які змінюють колір в залежності від середовища розчину
Лакмус
Метилоранж
Фенолфталеин

Слайд #41
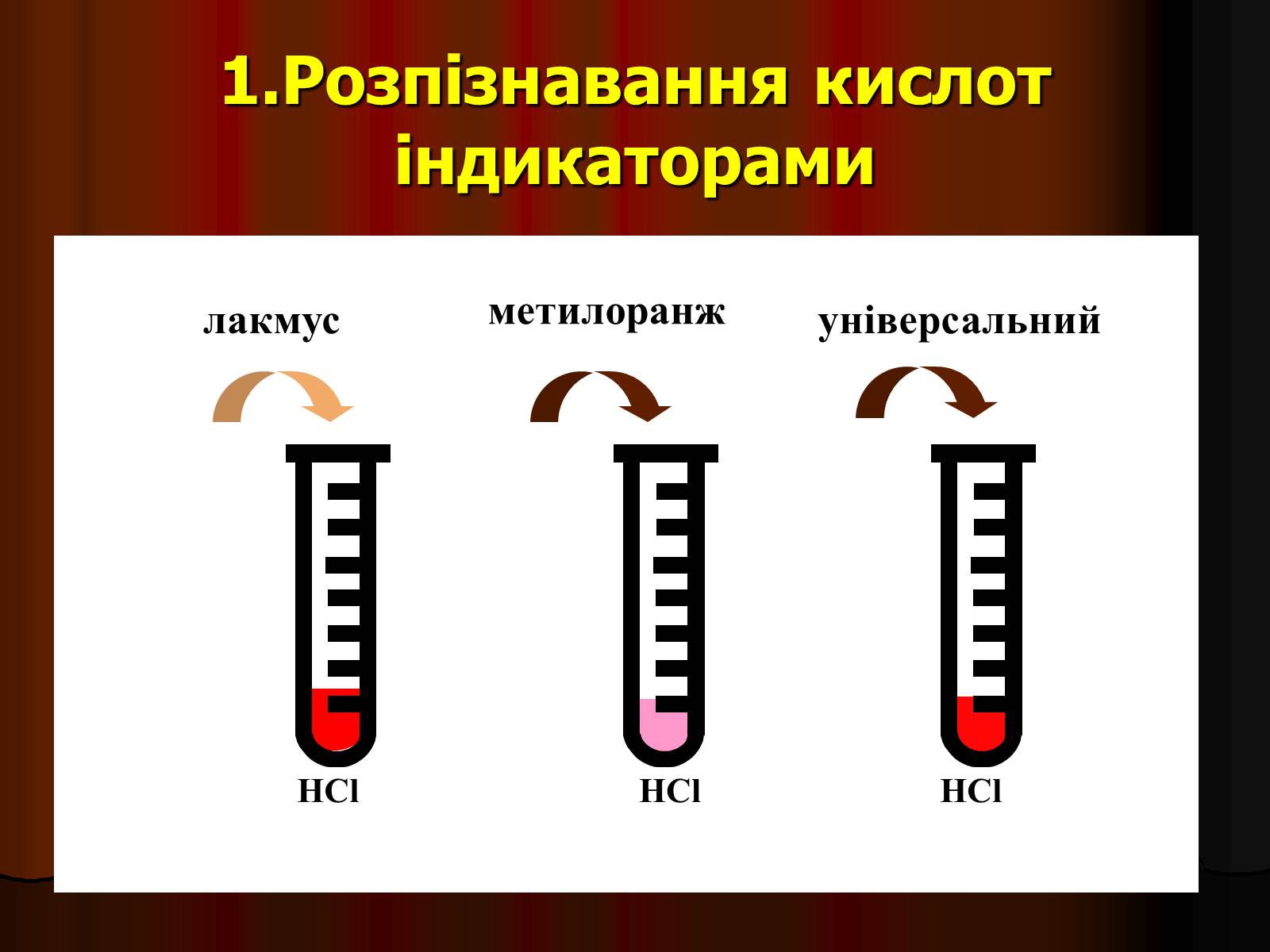
1.Розпізнавання кислот індикаторами
лакмус
метилоранж
універсальний
HCl
HCl
HCl
лакмус
метилоранж
універсальний
HCl
HCl
HCl
Слайд #42
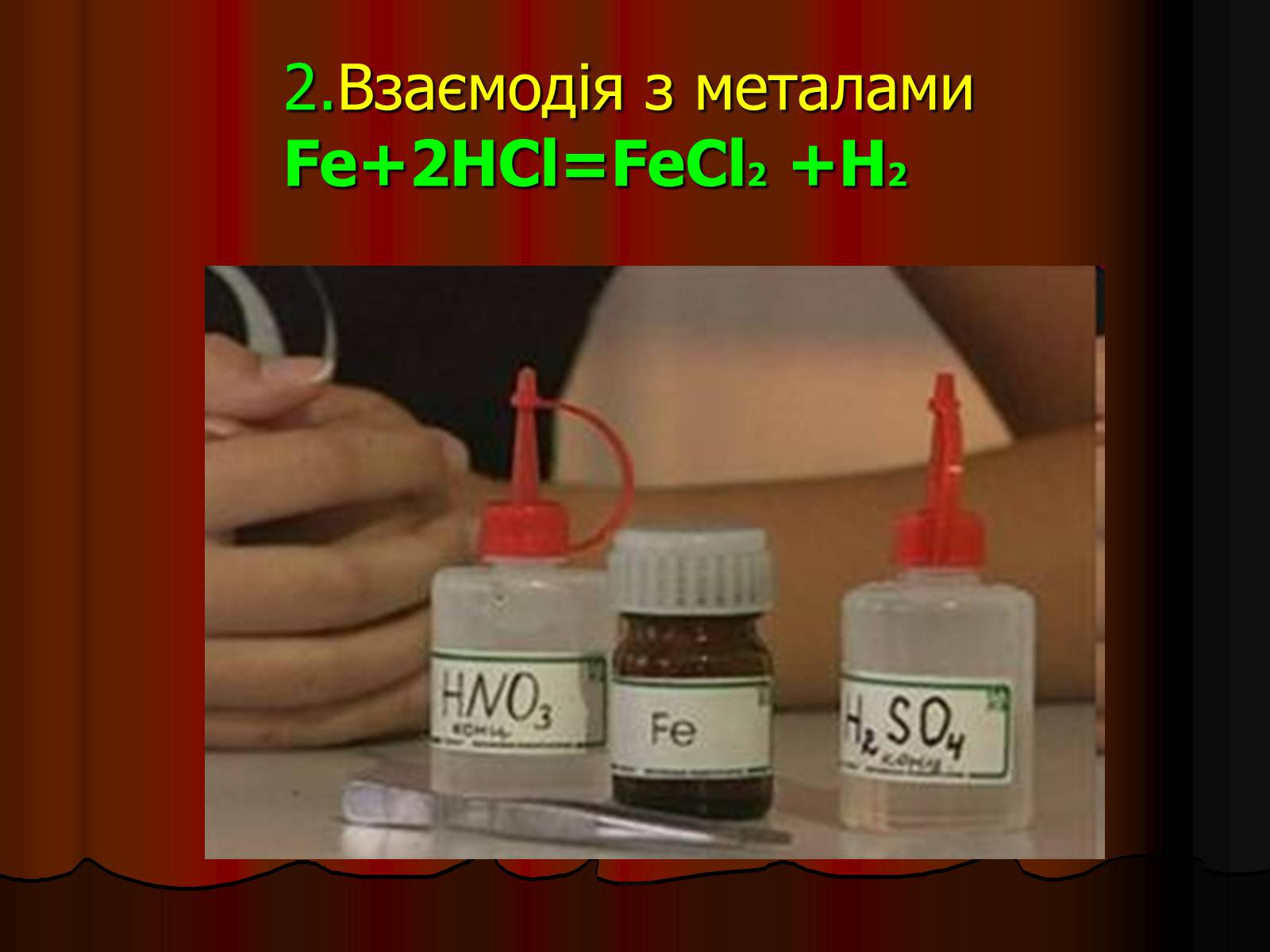
2.Взаємодія з металамиFe+2HCl=FeCl2 +H2
Слайд #43
3. Взаємодія з оксидами металів
CuO+2HCl= CuCl2+H2O
CuO+2HCl= CuCl2+H2O

Слайд #44
4.Взаємодія з основами(реакція нейтралізації)
HCl+KOH=KCl+H2O
HCl+KOH=KCl+H2O

Слайд #45
5. Взаємодія кислот з солямиNa2CO3+H2SO4=Na2SO4+H2O+CO2

Слайд #46
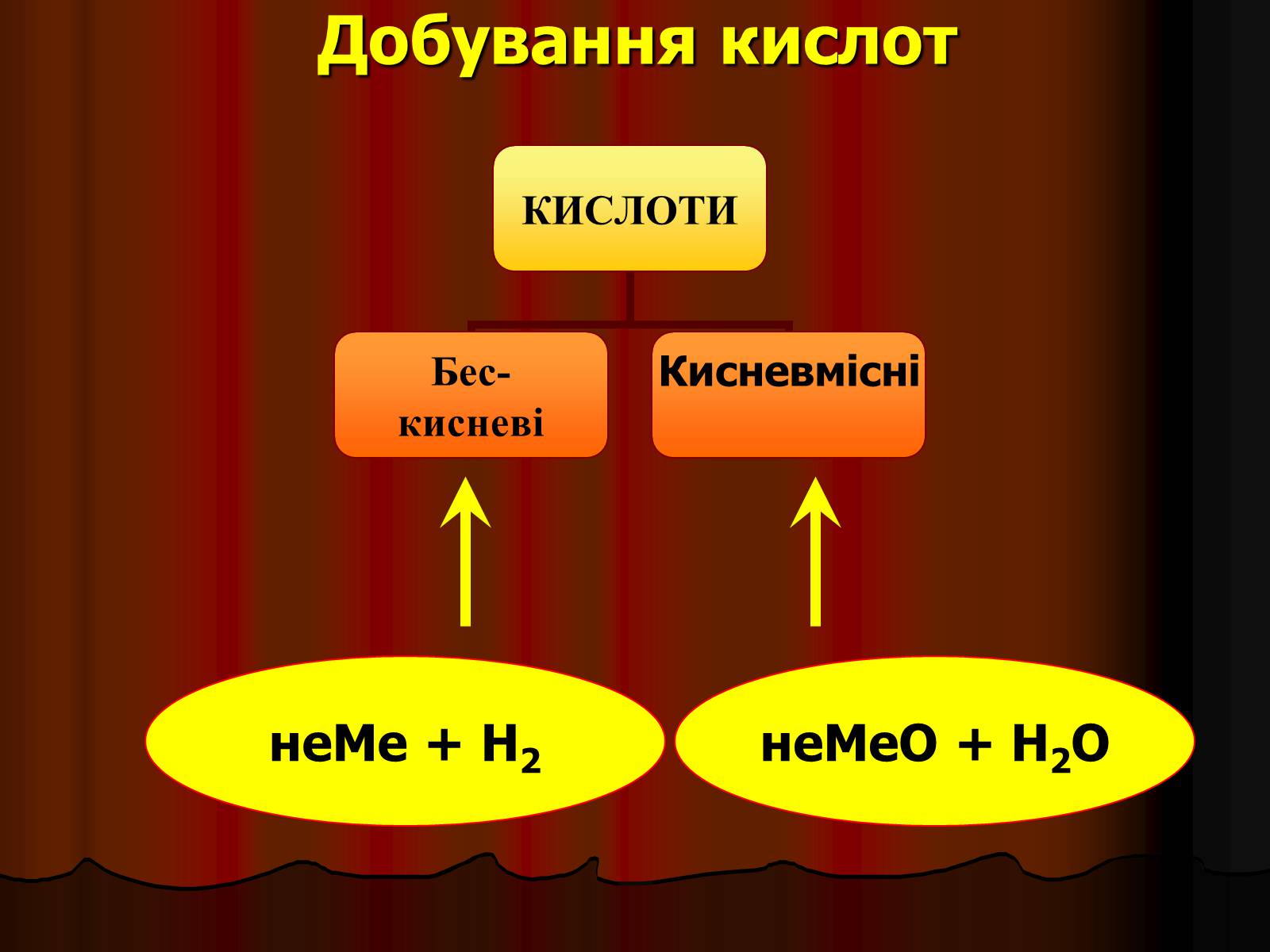
Добування кислот
неМе + Н2
неМеО + Н2О
неМе + Н2
неМеО + Н2О
Слайд #47
Хлоридна кислота знаходиться у шлунку, допомога перетравлювати їжу.
Молочна кислота утворюється у м'язах при физичному навантаженні.
КИСЛОТИ МІСТЯТЬСЯ В ОРГАНІЗМАХ ТВАРИН
Молочна кислота утворюється у м'язах при физичному навантаженні.
КИСЛОТИ МІСТЯТЬСЯ В ОРГАНІЗМАХ ТВАРИН

Слайд #48
КИСЛОТИ В МЕДИЦИНІ
Аскорбінова,
ацетилсаліцилова
Та ін.
Аскорбінова,
ацетилсаліцилова
Та ін.

Слайд #49
КИСЛОТИ В ХАРЧОВІЙ ПРОМИСЛОВОСТІ
Оцтова, лимонна
Та ін.
Оцтова, лимонна
Та ін.

Слайд #50
Поводження з кислотами

Слайд #51
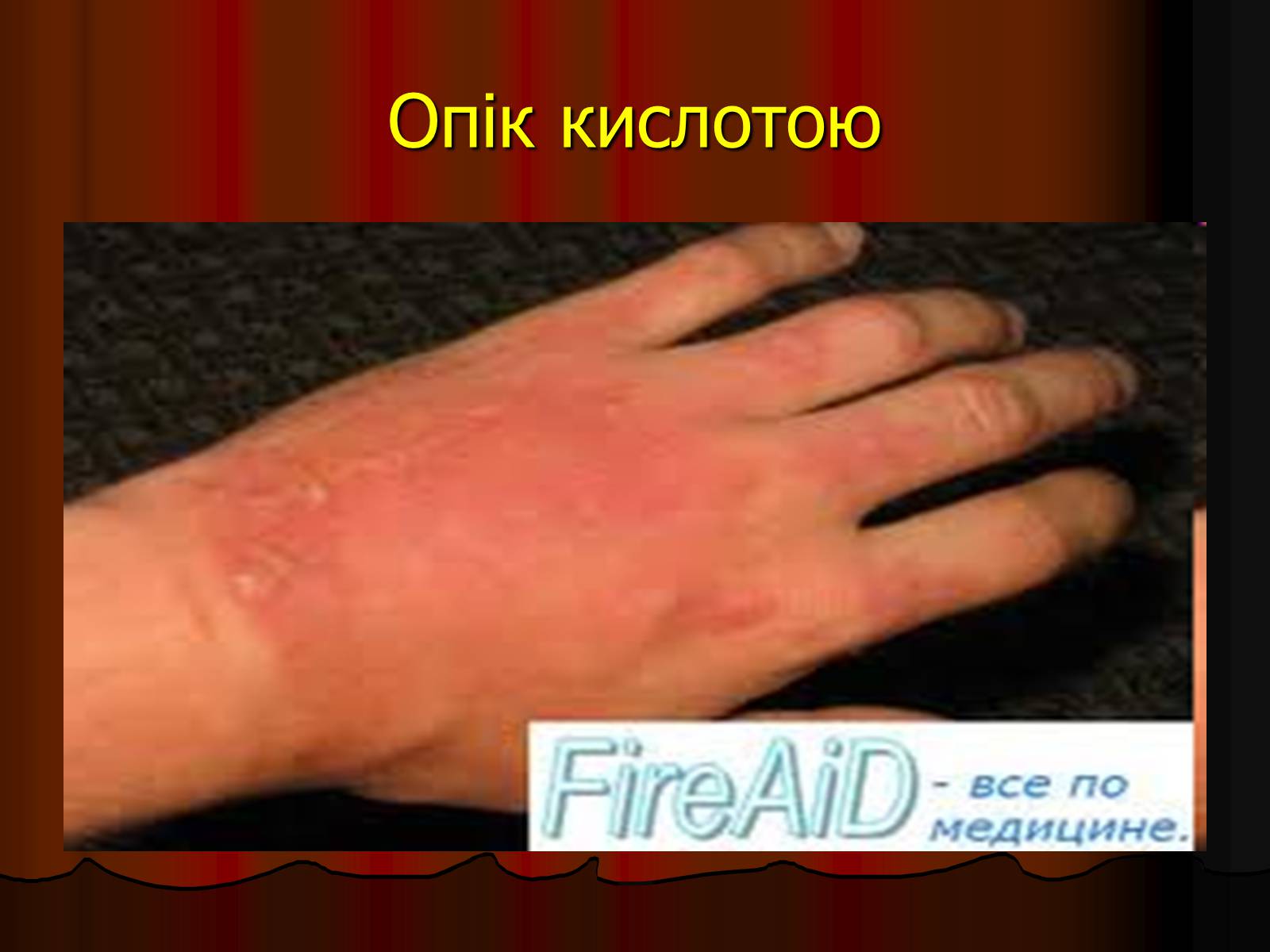
Опік кислотою
Слайд #52
Що запам'ятав?

Слайд #53
Що мене здивувало?

Слайд #54
Про що я довідався вперше?

Слайд #55
1. Де написані тільки кислоти:
а) NH3 HCl H2 SO4 б) H2S HNO3 HBr в) HCl KCl H3PO4
Закріплення
2. Яка речовина лишня:
а) HCl H2SO4 K2O
б) HNO3 H2O H2CO3
в) H2S H2SO4 NaOH
а) NH3 HCl H2 SO4 б) H2S HNO3 HBr в) HCl KCl H3PO4
Закріплення
2. Яка речовина лишня:
а) HCl H2SO4 K2O
б) HNO3 H2O H2CO3
в) H2S H2SO4 NaOH

Слайд #56
CuO, NaOH, H3PO4, CO2, CaCO3, HCl, Cu(OH)2, HNO3, BaO, H2S, K2SO3, H2SO4, Al(OH)3, AgNO3, H2CO3, NaSiO3, SO3, Al2(SO4)3
Виберіть кислоти;
Прокласифікуйте їх
Визначте валентність кислотних залишків
Виберіть кислоти;
Прокласифікуйте їх
Визначте валентність кислотних залишків

Слайд #57
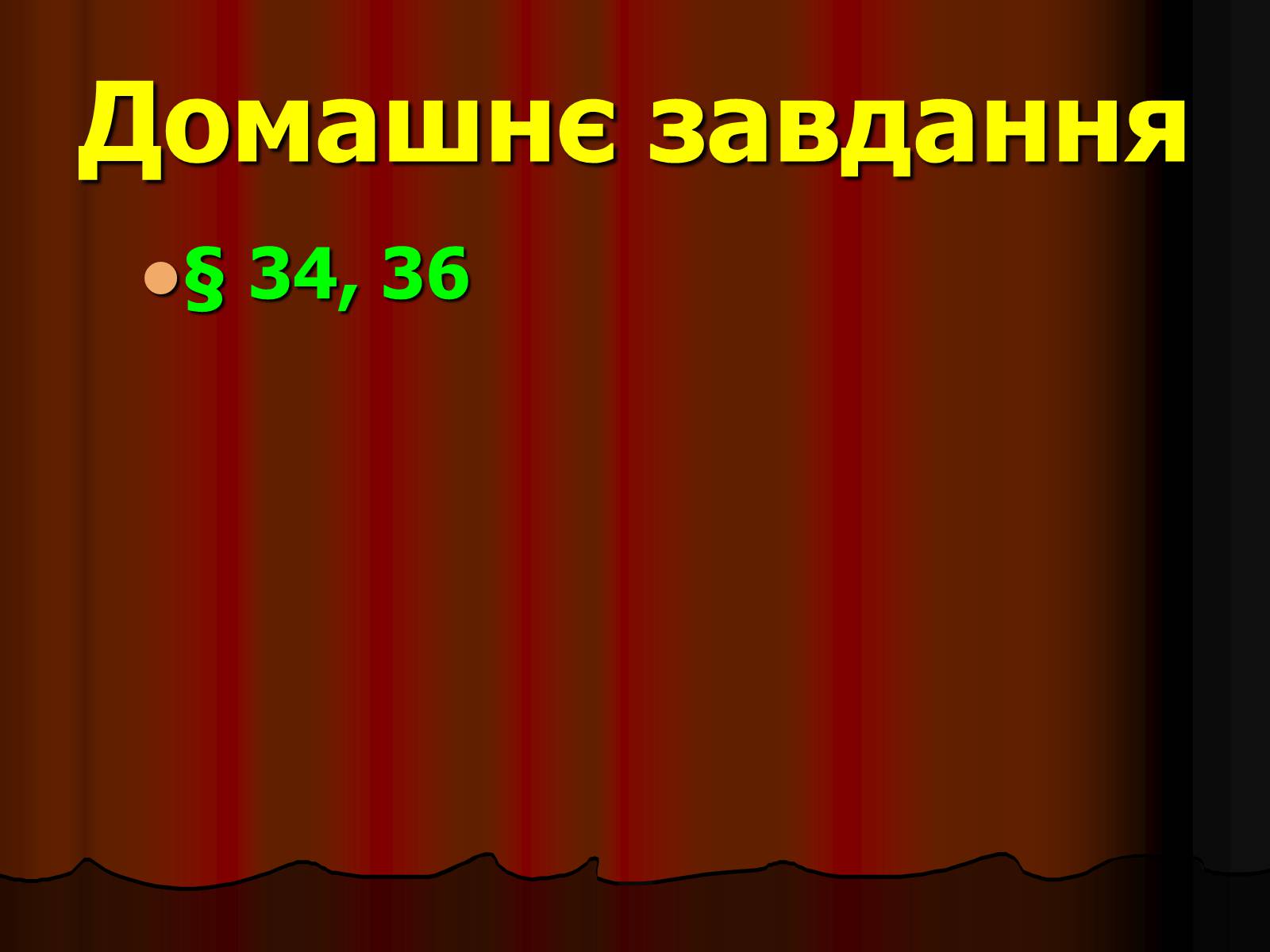
Домашнє завдання
§ 34, 36
§ 34, 36