- Головна
- Готові шкільні презентації
- Презентація на тему «Карбонатна кислота» (варіант 3)
Презентація на тему «Карбонатна кислота» (варіант 3)
282
Слайд #1
Карбонатна кислота і карбонати. Колообіг Карбону в природі

Слайд #2
Цілі: вивчимо склад та властивості карбонатної кислоти, з'ясуємо умови взаємного перетворення карбонатів(солей карбонатної кислоти), розглянемо кругообіг Карбону в природі та з'ясуємо значення цих сполук для людини.
Слайд #3
«Один раз під час бенкету Клеопатра заявила, що вип'є десять мільйонів сестерцій. Вона вийняла з вуха сергу з перлиною, рівної якої не було в усьому світі, і кинула її в чашу, де та вмить розчинилася. На очах здивованої публіки красуня залпом випила це питво».
Невдовзі після цього Клеопатру знайшли мертвою в її оселі, що ж стало причиною смерті великої богині Єгипту?».
Який напій випила Клеопатра? Що сталося з перлиною?
Невдовзі після цього Клеопатру знайшли мертвою в її оселі, що ж стало причиною смерті великої богині Єгипту?».
Який напій випила Клеопатра? Що сталося з перлиною?
Слайд #4
Хімічні властивості карбонатної кислоти
1) Ступінь окиснення Карбону- +2,+4
2) СО2- оксид карбону (ІV),вуглекислий газ;
СО- оксид карбону(ІІ), чадний газ.
3) СО2+Н2О=Н2СО3
1) Ступінь окиснення Карбону- +2,+4
2) СО2- оксид карбону (ІV),вуглекислий газ;
СО- оксид карбону(ІІ), чадний газ.
3) СО2+Н2О=Н2СО3

Слайд #5
Н2СО3
дуже нестійка кислота, на повітрі вона легко розкладається на карбон диоксид(СО2) і воду(Н2О), що є оборотною реакцією.
В чистому вигляді ії змогли одержати лише на холоді при температурі -30 *С в атмосфері рідкого естеру.
дуже нестійка кислота, на повітрі вона легко розкладається на карбон диоксид(СО2) і воду(Н2О), що є оборотною реакцією.
В чистому вигляді ії змогли одержати лише на холоді при температурі -30 *С в атмосфері рідкого естеру.

Слайд #6
Дисоціація:
Будучи двоосновною, вона дисоціює ступінчасте:
Будучи двоосновною, вона дисоціює ступінчасте:

Слайд #7
Чому під час відкривання пляшки спостерігаємо, як вуглекислий газ у вигляді бульбашок виходить з води?
Газовану воду під тиском насичують вуглекислим газом. Коли пляшку відкривають, тиск усередині її зменшується і вуглекислий газ у вигляді бульбашок виходить з води, тобто відбувається реакція:
Н2СО3=Н2О+СО2
Газовану воду під тиском насичують вуглекислим газом. Коли пляшку відкривають, тиск усередині її зменшується і вуглекислий газ у вигляді бульбашок виходить з води, тобто відбувається реакція:
Н2СО3=Н2О+СО2

Слайд #8
Цікаво знати:
Для плазми крові найважливіша буферна система - це карбонатна (вона складається з гідрокарбонату натрію NaHCO3 і карбонатної кислоти H2CO3.
Карбонатна буферна система добре справляється з регулюванням кислотності крові. Якщо в кров надходить підвищена кількість молочної кислоти, що утвориться в м'язах із глюкози при напруженій фізичній роботі, то вона нейтралізується. Виходить надлишок карбонатної кислоти у вигляді СО2 , що йде з подихом через легені.
Для плазми крові найважливіша буферна система - це карбонатна (вона складається з гідрокарбонату натрію NaHCO3 і карбонатної кислоти H2CO3.
Карбонатна буферна система добре справляється з регулюванням кислотності крові. Якщо в кров надходить підвищена кількість молочної кислоти, що утвориться в м'язах із глюкози при напруженій фізичній роботі, то вона нейтралізується. Виходить надлишок карбонатної кислоти у вигляді СО2 , що йде з подихом через легені.

Слайд #9
Солі карбонатної кислоти
середні-карбонати:
СаСО3, Na2CO3,
K2СО3
кислі - гідрогенкарбонати: Са(НСО3)2, NaНСО3
середні-карбонати:
СаСО3, Na2CO3,
K2СО3
кислі - гідрогенкарбонати: Са(НСО3)2, NaНСО3

Слайд #10
При нагріванні відбувається взаємне перетворення цих солей :
MgCO3 MgO + CO2 Mg(HCO3)2 MgCO3+CO2+H2O
MgCO3 MgO + CO2 Mg(HCO3)2 MgCO3+CO2+H2O

Слайд #11
Солі карбонатної кислоти:
NaНСО3 (натрій гідроген карбонат)- це питна сода, застосовується в медицині (інгаляції, полоскання), побуті, харчовій промисловості;
Na2 CO3 — кальцинована сода — застосовується у виробництві скла, мила, барвників, мийних засобів.
NaНСО3 (натрій гідроген карбонат)- це питна сода, застосовується в медицині (інгаляції, полоскання), побуті, харчовій промисловості;
Na2 CO3 — кальцинована сода — застосовується у виробництві скла, мила, барвників, мийних засобів.

Слайд #12
K2СО3 -поташ, який використовується у виробництві скла, мила, фотографії.
СаСО3-застосовують у будівництві, є у складі черепашок молюсків, кісток, дентину, входить до складу мармуру та перлин.
СаСО3-застосовують у будівництві, є у складі черепашок молюсків, кісток, дентину, входить до складу мармуру та перлин.

Слайд #13
Лабораторна робота
«Якісна реакція на карбонат-іони»
Мета: навчитися визначати в розчині карбонат-іони
Обладнання: штатив з пробірками, газовідвідна трубка, хімічний стакан.
Реактиви: кристалічні солі – натрій карбонат, кальцій карбонат, кальцій гідроксид(вапняна вода), розведена хлоридна кислота.
«Якісна реакція на карбонат-іони»
Мета: навчитися визначати в розчині карбонат-іони
Обладнання: штатив з пробірками, газовідвідна трубка, хімічний стакан.
Реактиви: кристалічні солі – натрій карбонат, кальцій карбонат, кальцій гідроксид(вапняна вода), розведена хлоридна кислота.

Слайд #14
Правила техніки безпеки при роботі з кислотами!!!

Слайд #15
Хід роботи:
В пробірки з солями додайте по 1 мл розведеної хлоридної кислоти;
Закрийте пробірки пробкою з газовідвідною трубкою, кінець якої опустіть в пробірку з вапняною водою Са(ОН)2
Запишіть рівняння відповідних реакцій
В пробірки з солями додайте по 1 мл розведеної хлоридної кислоти;
Закрийте пробірки пробкою з газовідвідною трубкою, кінець якої опустіть в пробірку з вапняною водою Са(ОН)2
Запишіть рівняння відповідних реакцій

Слайд #16
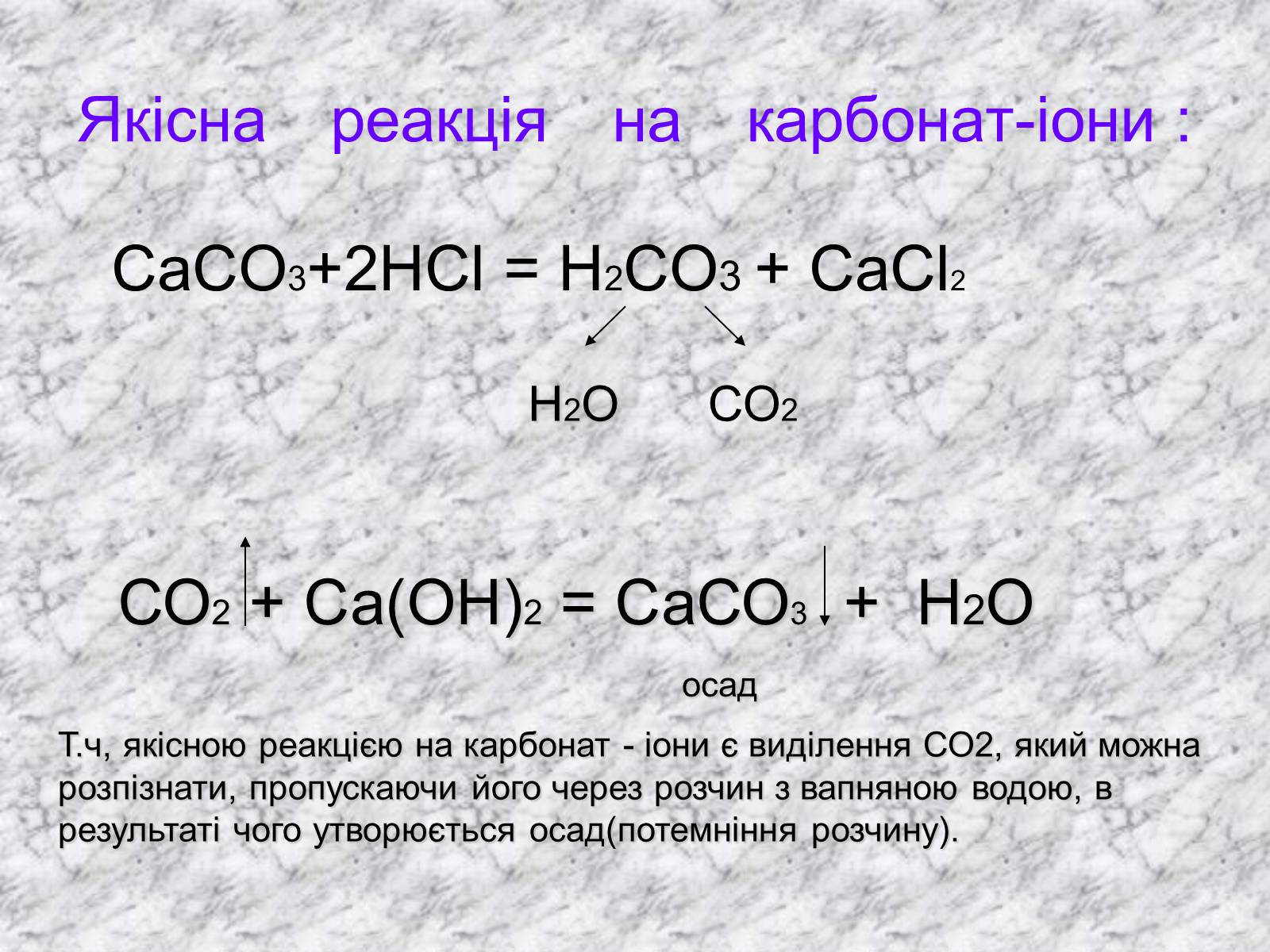
Якісна реакція на карбонат-іони :
СаСО3+2НСl = Н2СО3 + СаСl2
Н2О
СО2
СО2 + Са(ОН)2 = СаСО3 + Н2О
осад
Т.ч, якісною реакцією на карбонат - іони є виділення СО2, який можна розпізнати, пропускаючи його через розчин з вапняною водою, в результаті чого утворюється осад(потемніння розчину).
СаСО3+2НСl = Н2СО3 + СаСl2
Н2О
СО2
СО2 + Са(ОН)2 = СаСО3 + Н2О
осад
Т.ч, якісною реакцією на карбонат - іони є виділення СО2, який можна розпізнати, пропускаючи його через розчин з вапняною водою, в результаті чого утворюється осад(потемніння розчину).
Слайд #17
мета: дослідити дію «Calgon» і «Cillit BANG», з'ясувати, які реакції відбуваються під час їх використання.
«Calgon»
Склад:містить менш чим 5% аніонних ПАВ, 15-30% карбонату натрію(Na2СО3), натрій перкарбонат , ортофосфатну кислоту(Н3РО4) а також лимонен.
«Cillit BANG»
Склад:складається із сухого гексаметафосфата натрію (натрій polyphospate аморфний) та карбонатних солей, які у воді, що оточує комплекс іона кальцію й деякі інші катіони, перешкоджають утворенню небажаних солей і втручання з боку цих катіонів.
«Calgon»
Склад:містить менш чим 5% аніонних ПАВ, 15-30% карбонату натрію(Na2СО3), натрій перкарбонат , ортофосфатну кислоту(Н3РО4) а також лимонен.
«Cillit BANG»
Склад:складається із сухого гексаметафосфата натрію (натрій polyphospate аморфний) та карбонатних солей, які у воді, що оточує комплекс іона кальцію й деякі інші катіони, перешкоджають утворенню небажаних солей і втручання з боку цих катіонів.

Слайд #18
Ці речовини пошкоджують шкіру й можуть викликати алергійну реакцію, так що необхідно обережно використовувати ці хімічно-активні миючі засоби.
Чому засіб не можна використовувати для поверхонь з мармуру?
2Н3РО4+3СаСО3=3Н2СО3+Са3(РО4)2
Чому засіб не можна використовувати для поверхонь з мармуру?
2Н3РО4+3СаСО3=3Н2СО3+Са3(РО4)2

Слайд #19
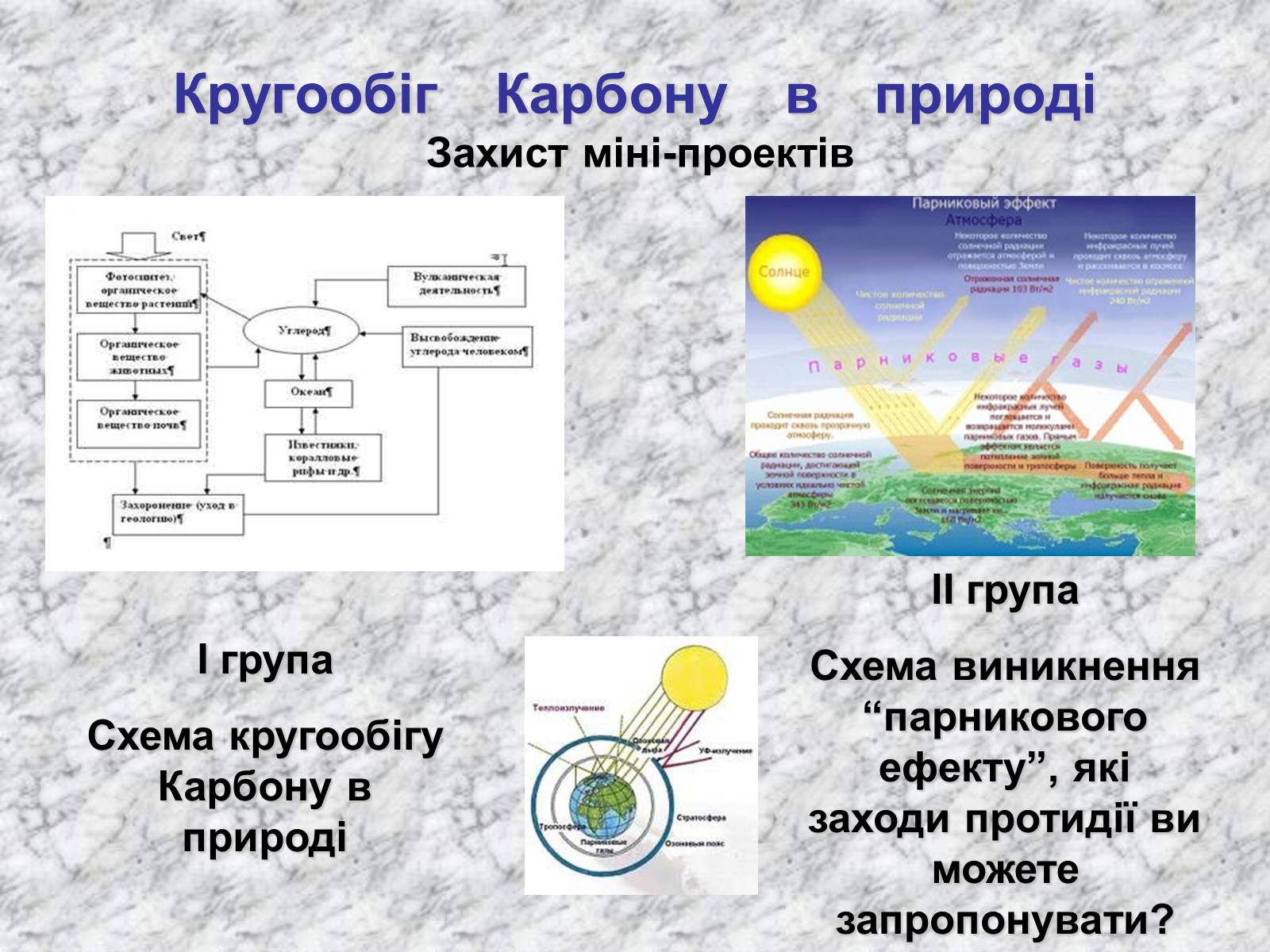
Кругообіг Карбону в природі Захист міні-проектів
І група
Схема кругообігу Карбону в природі
ІІ група
Схема виникнення “парникового ефекту”, які заходи протидії ви можете запропонувати?
І група
Схема кругообігу Карбону в природі
ІІ група
Схема виникнення “парникового ефекту”, які заходи протидії ви можете запропонувати?
Слайд #20
Домашнє завдання
Опрацювати параграфи 22,23.
Творче завдання:
З'ясувати, з чим пов'язане утворення накипу всередині чайника, запропонувати найефективніші способи його усунення.
Опрацювати параграфи 22,23.
Творче завдання:
З'ясувати, з чим пов'язане утворення накипу всередині чайника, запропонувати найефективніші способи його усунення.

Слайд #21
Дякую за плідну працю!
