- Головна
- Готові шкільні презентації
- Презентація на тему «Використання вуглеводнів» (варіант 1)
Презентація на тему «Використання вуглеводнів» (варіант 1)
321
Слайд #1
Використання вуглеводнів
Урок №10
Урок №10

Слайд #2
7
1
2
3
4
6
5
Як називаються вуглеводні, в молекулах яких є лише прості (ординарні) зв'язки?
8
9
10
14
15
13
12
11
Назвіть загальну формулу насичених вуглеводнів.
Як називаються вуглеводні, в молекулах яких є один подвійний зв'язок?
Назвіть загальну формулу етиленових вуглеводнів.
Як називаються вуглеводні, в молекулах яких є один потрійний зв'язок?
Назвіть загальну формулу ацетиленових вуглеводнів.
До яких гомологічних рядів належать речовини, формули яких наведено нижче:
А) С2Н4; Б) С5Н12; В) С4Н6;
Г) С3Н8; Д) С2Н2; Е) С8Н16.
Назвіть речовини.
Позначте суфікс, за допомогою якого утворюються назви гомологів метану:
А) –ан; Б). –ен; В). –ін (-ин);
Г). –ил (-іл.); Д) –ол.
Позначте суфікс, за допомогою якого утворюються назви гомологів етану:
А) –ан; Б). –ен; В). –ін (-ин);
Г). –ил (-іл.); Д) –ол.
Позначте суфікс, за допомогою якого утворюються назви гомологів ацетилену:
А) –ан; Б). –ен; В). –ін (-ин);
Г). –ил (-іл.); Д) –ол.
Які реакції найтиповіші для насичених вуглеводнів?
Які реакції найтиповіші для ненасичених вуглеводнів?
Які реакції називаються реакціями гідрування (гідрогенізації)?
Які реакції називаються реакціями гідрогалогенування?
Які реакції називаються реакціями полімеризації?
Молодці!
1
2
3
4
6
5
Як називаються вуглеводні, в молекулах яких є лише прості (ординарні) зв'язки?
8
9
10
14
15
13
12
11
Назвіть загальну формулу насичених вуглеводнів.
Як називаються вуглеводні, в молекулах яких є один подвійний зв'язок?
Назвіть загальну формулу етиленових вуглеводнів.
Як називаються вуглеводні, в молекулах яких є один потрійний зв'язок?
Назвіть загальну формулу ацетиленових вуглеводнів.
До яких гомологічних рядів належать речовини, формули яких наведено нижче:
А) С2Н4; Б) С5Н12; В) С4Н6;
Г) С3Н8; Д) С2Н2; Е) С8Н16.
Назвіть речовини.
Позначте суфікс, за допомогою якого утворюються назви гомологів метану:
А) –ан; Б). –ен; В). –ін (-ин);
Г). –ил (-іл.); Д) –ол.
Позначте суфікс, за допомогою якого утворюються назви гомологів етану:
А) –ан; Б). –ен; В). –ін (-ин);
Г). –ил (-іл.); Д) –ол.
Позначте суфікс, за допомогою якого утворюються назви гомологів ацетилену:
А) –ан; Б). –ен; В). –ін (-ин);
Г). –ил (-іл.); Д) –ол.
Які реакції найтиповіші для насичених вуглеводнів?
Які реакції найтиповіші для ненасичених вуглеводнів?
Які реакції називаються реакціями гідрування (гідрогенізації)?
Які реакції називаються реакціями гідрогалогенування?
Які реакції називаються реакціями полімеризації?
Молодці!
Слайд #3
1. Застосування насичених вуглеводнів
2. Застосування етилену
3. Застосування ацетилену
4. Розв'язування вправ та задач
План уроку:
2. Застосування етилену
3. Застосування ацетилену
4. Розв'язування вправ та задач
План уроку:

Слайд #4
Значення насичених вуглеводнів

Слайд #5
Як паливо
Природний газ (СН4) – пальне на електростанціях
С3Н8 та С4Н10 - паливо в газових плитах та моторне паливо.
Рідкі алкани – бензин, гас
Природний газ (СН4) – пальне на електростанціях
С3Н8 та С4Н10 - паливо в газових плитах та моторне паливо.
Рідкі алкани – бензин, гас

Слайд #6
Парафін (С17 – С40)
В медицині та побуті
Пакувальний матеріал. Застосовується для захисту від вологи промислових товарів
Свічки
Теплові процедури при лікуванні захворювань суглобів
В медицині та побуті
Пакувальний матеріал. Застосовується для захисту від вологи промислових товарів
Свічки
Теплові процедури при лікуванні захворювань суглобів

Слайд #7
Озокерит
(гірський віск)
(суміш твердих вуглеводнів) - в медицині для лікувальних теплових процедур
Вазелінове масло (до С15) в медицині, парфумерії , косметиці
Вазелін (до С25)
Виготовлення мазей
(гірський віск)
(суміш твердих вуглеводнів) - в медицині для лікувальних теплових процедур
Вазелінове масло (до С15) в медицині, парфумерії , косметиці
Вазелін (до С25)
Виготовлення мазей

Слайд #8
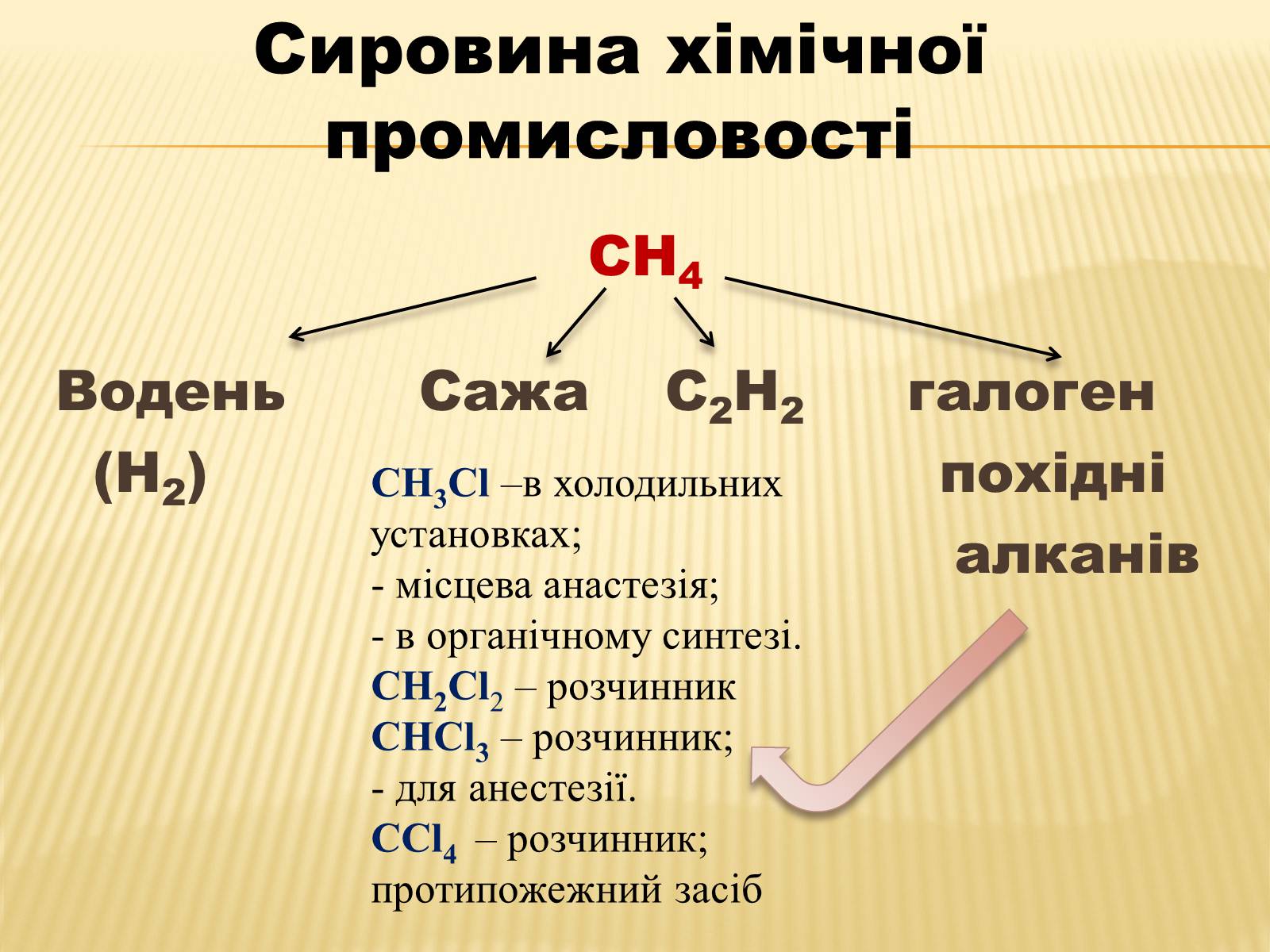
СН4
Водень Сажа С2Н2 галоген
(Н2) похідні
алканів
Сировина хімічної промисловості
СН3Сl –в холодильних установках;
- місцева анастезія;
- в органічному синтезі.
СН2Сl2 – розчинник
СНСl3 – розчинник;
- для анестезії.
ССl4 – розчинник;
протипожежний засіб
Водень Сажа С2Н2 галоген
(Н2) похідні
алканів
Сировина хімічної промисловості
СН3Сl –в холодильних установках;
- місцева анастезія;
- в органічному синтезі.
СН2Сl2 – розчинник
СНСl3 – розчинник;
- для анестезії.
ССl4 – розчинник;
протипожежний засіб
Слайд #9
Застосування етилену

Слайд #10
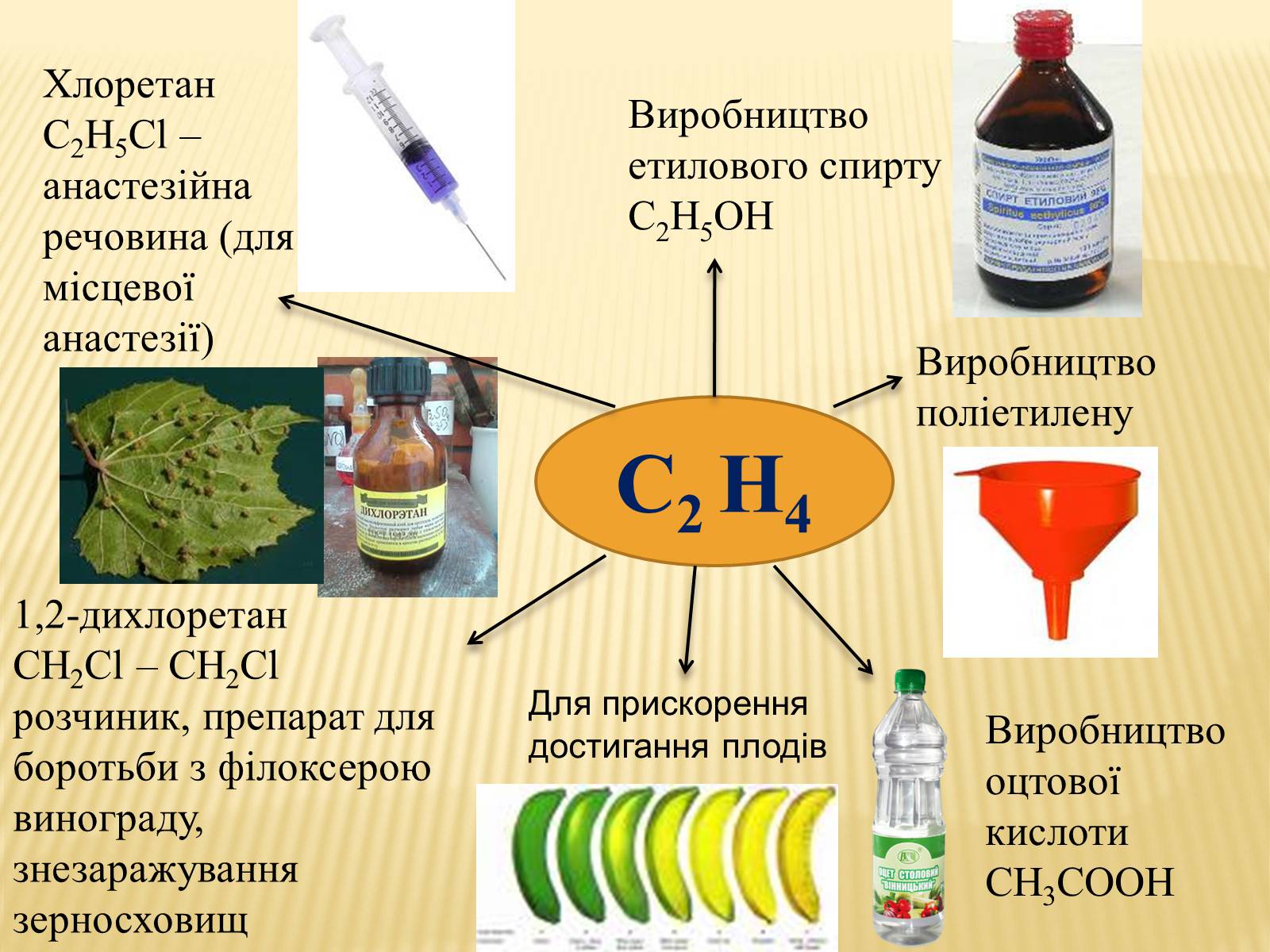
Виробництво етилового спирту С2Н5ОН
Виробництво поліетилену
Виробництво оцтової кислоти СН3СООН
1,2-дихлоретан
СН2Сl – СН2Cl розчиник, препарат для боротьби з філоксерою винограду, знезаражування зерносховищ
Хлоретан С2Н5Сl –анастезійна речовина (для місцевої анастезії)
С2 Н4
Для прискорення достигання плодів
Виробництво поліетилену
Виробництво оцтової кислоти СН3СООН
1,2-дихлоретан
СН2Сl – СН2Cl розчиник, препарат для боротьби з філоксерою винограду, знезаражування зерносховищ
Хлоретан С2Н5Сl –анастезійна речовина (для місцевої анастезії)
С2 Н4
Для прискорення достигання плодів
Слайд #11
Застосування ацетилену

Слайд #12
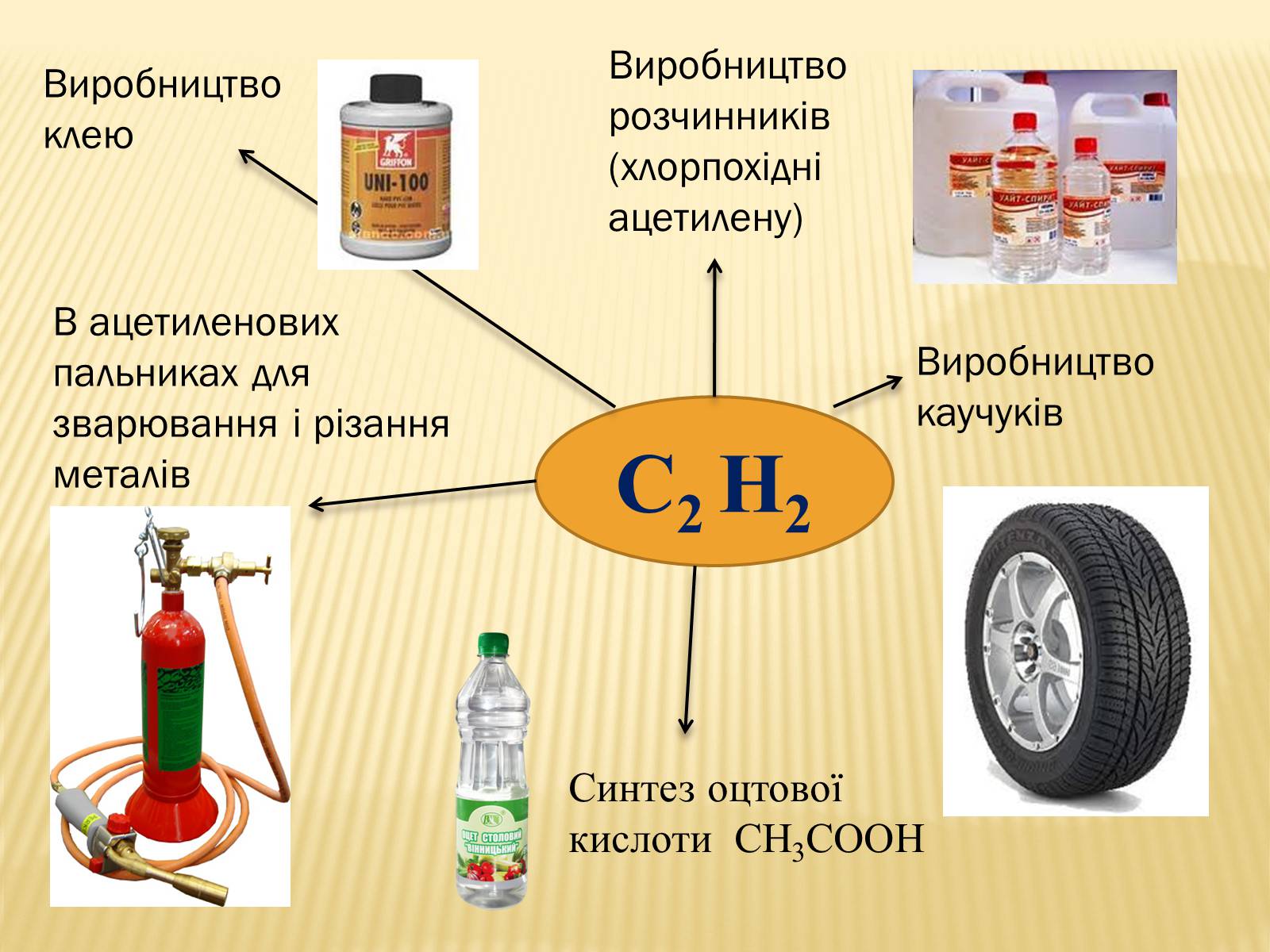
Виробництво розчинників (хлорпохідні ацетилену)
Виробництво каучуків
Синтез оцтової кислоти СН3СООН
В ацетиленових пальниках для зварювання і різання металів
Виробництво клею
С2 Н2
Виробництво каучуків
Синтез оцтової кислоти СН3СООН
В ацетиленових пальниках для зварювання і різання металів
Виробництво клею
С2 Н2
Слайд #13
Розв´зування задач

Слайд #14
1. Продукт приєднання хлору до етилену – дихлоретан - набув широкого застосування для боротьби із комірними шкідниками. Обчислить, яка маса етилену буде потрібна для одержання 198г дихлоретану.
2. 6,8г ацетиленового вуглеводню повністю прореагували із 4,48л водню (н.у.). Знайдіть молекулярну формулу вуглеводню.
3. 1,4г алкену приєднують 0,746л бромоводню (н.у.). Знайдіть молекулярну формулу вуглеводню.
4*. Яка маса кальцій карбіду з масовою часткою домішок 5% знадобиться для одержання 18л (н.у.)ацетилену, якщо вихід продукту реакції становить 80%.
2. 6,8г ацетиленового вуглеводню повністю прореагували із 4,48л водню (н.у.). Знайдіть молекулярну формулу вуглеводню.
3. 1,4г алкену приєднують 0,746л бромоводню (н.у.). Знайдіть молекулярну формулу вуглеводню.
4*. Яка маса кальцій карбіду з масовою часткою домішок 5% знадобиться для одержання 18л (н.у.)ацетилену, якщо вихід продукту реакції становить 80%.

Слайд #15
Домашнє завдання:
Повторити § 19-23
Здійснити перетворення:
А) СН4 → СН3Cl → C2H6 → C2H5Cl → C4H10 → CO2
Б) C3H6 → C3H7Cl
C3H8
C3H6Br2
В) CaC2 → C2H2 → C2H4 → (- CH2 - CH2 -)n
Творче завдання: придумати ланцюг перетворень (10 рівнянь) обов'язковою речовиною в якому є метан.
Повторити § 19-23
Здійснити перетворення:
А) СН4 → СН3Cl → C2H6 → C2H5Cl → C4H10 → CO2
Б) C3H6 → C3H7Cl
C3H8
C3H6Br2
В) CaC2 → C2H2 → C2H4 → (- CH2 - CH2 -)n
Творче завдання: придумати ланцюг перетворень (10 рівнянь) обов'язковою речовиною в якому є метан.
