- Головна
- Готові шкільні презентації
- Презентація на тему «Алюміній» (варіант 9)
Презентація на тему «Алюміній» (варіант 9)
306
Слайд #1
Al
Алюміній
Підготував:
учень 10-Б класу
Федоренко Роман
Алюміній
Підготував:
учень 10-Б класу
Федоренко Роман

Слайд #2
Al
13
Алюміній(лат. Aluminium)
3
8
2
26,9815
3s2 3p1
Порядковий номер. Хімічний елемент III групи головної підгрупи 3-го періоду.
13
Алюміній(лат. Aluminium)
3
8
2
26,9815
3s2 3p1
Порядковий номер. Хімічний елемент III групи головної підгрупи 3-го періоду.

Слайд #3
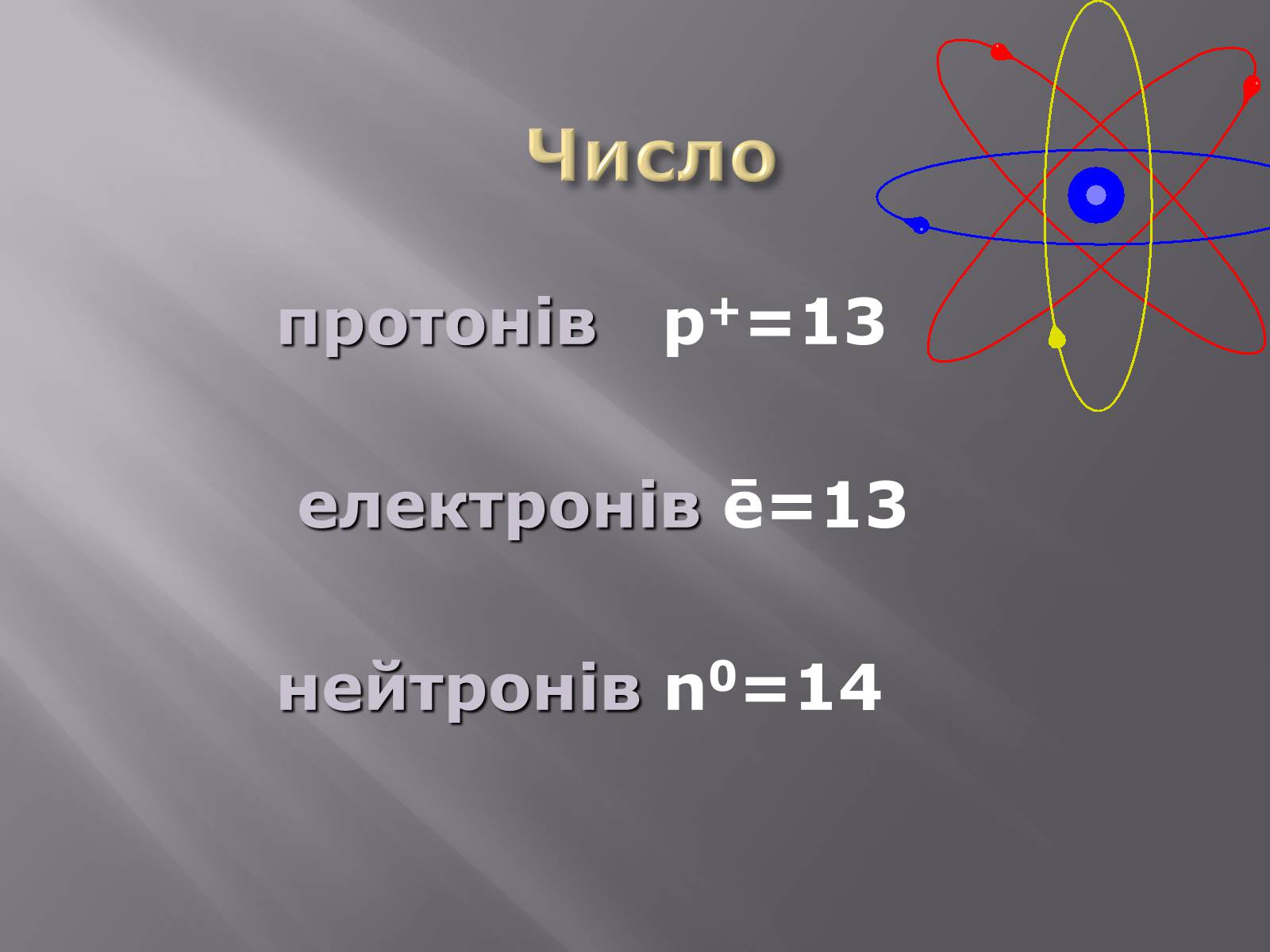
Число
протонів p+=13
електронів ē=13
нейтронів n0=14
протонів p+=13
електронів ē=13
нейтронів n0=14
Слайд #4
Схема розташування електронів на енергетичних рівнях
+13Al 1s2 2s2 2p6 3s2 3p1
1s
2s
2p
3s
3p
в сполуках проявляє степінь окиснення +3
+13Al 1s2 2s2 2p6 3s2 3p1
1s
2s
2p
3s
3p
в сполуках проявляє степінь окиснення +3

Слайд #5
Al – типовий амфотерний елемент
Відновлювальні властивості
Al 0- 3ē Al+3
Тип хімічного зв'язку - металевий
Тип кристалічної гратки – кубічна гранецентрированна
Відновлювальні властивості
Al 0- 3ē Al+3
Тип хімічного зв'язку - металевий
Тип кристалічної гратки – кубічна гранецентрированна

Слайд #6
Фізичні властивості речовини
Al – срібно-білий метал, пластичний, легкий, добре проводить тепло и електричний струм, легко обробляється, створює легкі и міцні сплави.
=2,7 г/см3
tпл.=6600С
Al – срібно-білий метал, пластичний, легкий, добре проводить тепло и електричний струм, легко обробляється, створює легкі и міцні сплави.
=2,7 г/см3
tпл.=6600С

Слайд #7
Особливості фізичних і хімічних властивостей алюмінія, його місце в природі і застосування:
Алюміній – найросповсюдженіший метал земної кори. Його ресурси практично невичерпні.
Має високу коррозійну стійкість і практично не потребує спеціального захисту.
Висока хімічна активність алюмінія використовується в алюмінотермії.
Мала густина в поєднанні з високою міцністю і пластичністю його сплавів робить алюміній незамінним конструкційним матеріалом в літакобудуванні і сприяє розширенню його застосування в наземному і водному транспорті, а також в будівництві.
Відносно висока електропровідність дозволяє заміняти ним значно дорожчу мідь в електротехніці.
Алюміній – найросповсюдженіший метал земної кори. Його ресурси практично невичерпні.
Має високу коррозійну стійкість і практично не потребує спеціального захисту.
Висока хімічна активність алюмінія використовується в алюмінотермії.
Мала густина в поєднанні з високою міцністю і пластичністю його сплавів робить алюміній незамінним конструкційним матеріалом в літакобудуванні і сприяє розширенню його застосування в наземному і водному транспорті, а також в будівництві.
Відносно висока електропровідність дозволяє заміняти ним значно дорожчу мідь в електротехніці.

Слайд #8
Алюміній реагує з простими речовинами - неметалами
4Al+3O2 = 2Al2O3
Поверхня покривається плівкою оксиду, в подрібеному виді горить з виділенням великої кількості тепла.
2. 2Al + 3Cl2 = 2 AlCl3
3. 2Al + 3S = Al2S3 - при нагріванні
4. 4Al + 3С = Al4С3 – при нагріванні
4Al+3O2 = 2Al2O3
Поверхня покривається плівкою оксиду, в подрібеному виді горить з виділенням великої кількості тепла.
2. 2Al + 3Cl2 = 2 AlCl3
3. 2Al + 3S = Al2S3 - при нагріванні
4. 4Al + 3С = Al4С3 – при нагріванні

Слайд #9
Алюміній реагує з складними речовинами :
Алюміній розчиняється в розчинах кислот
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2. Алюміній реагує з розчинами солей менш активних металів
2Al + 3СuCl2 = 2AlCl3 + 3Cu
Алюміній розчиняється в розчинах кислот
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2. Алюміній реагує з розчинами солей менш активних металів
2Al + 3СuCl2 = 2AlCl3 + 3Cu

Слайд #10
Алюміній реагує з складними речовинами
3. Алюміній при високій температурі реагує з оксидами менш активних металів (Алюмінотермія – добування металів: Fe, Cr, Mn, Ti, W і інших, шляхом їх відновлення алюмінієм)
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
3. Алюміній при високій температурі реагує з оксидами менш активних металів (Алюмінотермія – добування металів: Fe, Cr, Mn, Ti, W і інших, шляхом їх відновлення алюмінієм)
8Al + 3Fe3O4 = 4Al2O3 + 9Fe

Слайд #11
Алюміній реагує з складними речовинами
4.Так як алюміній – амфотерний метал, він реагує з розчинами лугів.
При цьому утворюється тетрагідроксоалюмінат натрію і виділяється водень:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
5. При видаленні оксидної плівки з поверхні алюмінію, він реагує з водою з утворенням гідроксиду алюмінія і водню:
2Al + 6H2O = 2Al(OH)3 +3H2
4.Так як алюміній – амфотерний метал, він реагує з розчинами лугів.
При цьому утворюється тетрагідроксоалюмінат натрію і виділяється водень:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
5. При видаленні оксидної плівки з поверхні алюмінію, він реагує з водою з утворенням гідроксиду алюмінія і водню:
2Al + 6H2O = 2Al(OH)3 +3H2

Слайд #12
Добування алюмінію
Алюміній добувають електролізом розчину глинозему у розплавленому кріоліті (Na3AlF6) і
електролізом розплаву AlCl3
Алюміній добувають електролізом розчину глинозему у розплавленому кріоліті (Na3AlF6) і
електролізом розплаву AlCl3

Слайд #13
Застосування Al
Слайд #14
Поширеність алюмінію В природі алюміній зустрічається тільки в виді сполук і по розповсюдженості в земній корі займає перше місце серед металів і третє – серед всіх елементів (після кисню и кремнію). Загальній вміст алюмінію в земній корі становить 8,8 % за масою

Слайд #15
Оксид алюмінію Al2О3:
Дуже твердий (корунд, рубін) в кристалічному стан, порошок білого кольору, тугоплавкий - 20500С.
Не розчиняється в воді.
Амфотерний оксид, взаємодіє:
а) з кислотами Al2O3 + 6H+ = 2Al3+ + 3H2O
б) з лугами Al2O3 + 2OH- = 2AlO-2 + H2O
Утворюється:
а) при окисненні або горінні алюмінію на повітрі
4Al + 3O2 = 2Al2O3
б) в реакції алюмінотермії
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термічному розкладі гідроксиду алюмінія t t2Al (OH)3 = Al2O3 + 3H2O
Дуже твердий (корунд, рубін) в кристалічному стан, порошок білого кольору, тугоплавкий - 20500С.
Не розчиняється в воді.
Амфотерний оксид, взаємодіє:
а) з кислотами Al2O3 + 6H+ = 2Al3+ + 3H2O
б) з лугами Al2O3 + 2OH- = 2AlO-2 + H2O
Утворюється:
а) при окисненні або горінні алюмінію на повітрі
4Al + 3O2 = 2Al2O3
б) в реакції алюмінотермії
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термічному розкладі гідроксиду алюмінія t t2Al (OH)3 = Al2O3 + 3H2O

Слайд #16
Гідроксид алюмінію Al(ОН)3
Білий нерозчинний в воді порошок.
Проявляє амфотерні властивості, взаємодіє:
а) з кислотами Al (OH)3 + 3HCl = AlCl3 + 3H2O
б) з лугами Al (OH)3 + Na OH = NaAlO2 + 2H2O
Розкладається при нагріванні 2Al (OH)3 = Al2O3 + 3H2O
Утворюється:
а) при взаємодії розчинів солей алюмінію з розчинами лугів ttAl3+ + 3OH- = Al (OH)3
б) при взаємодії алюмінатів з кислотами
AlO-2 + H+ + H2O = Al (OH)3
Білий нерозчинний в воді порошок.
Проявляє амфотерні властивості, взаємодіє:
а) з кислотами Al (OH)3 + 3HCl = AlCl3 + 3H2O
б) з лугами Al (OH)3 + Na OH = NaAlO2 + 2H2O
Розкладається при нагріванні 2Al (OH)3 = Al2O3 + 3H2O
Утворюється:
а) при взаємодії розчинів солей алюмінію з розчинами лугів ttAl3+ + 3OH- = Al (OH)3
б) при взаємодії алюмінатів з кислотами
AlO-2 + H+ + H2O = Al (OH)3

Слайд #17
Дякую за увагу!
