- Головна
- Готові шкільні презентації
- Презентація на тему «Сульфати»
Презентація на тему «Сульфати»
248
Слайд #1
Мета уроку: дати знання з даної теми
Завдання
уроку
Розширити знання про солі
на прикладі властивостей сульфатів,
та їх застосування;
повторити правила
безпеки праці при роботі
з кислотами і солями;
знати якісну реакцію на
сульфат – йони, удосконалити
уміння писати рівняння реакцій
йонного обміну;
сформувати уміння розв'язувати
задачі за хімічними рівняннями
в разі надлишку одного з реагентів;
підвищити пізнавальний інтерес до вивчення хімії шляхом ознайомлення з цікавими фактами, природними мінералами та дослідами
розвивати логічне мислення
Завдання
уроку
Розширити знання про солі
на прикладі властивостей сульфатів,
та їх застосування;
повторити правила
безпеки праці при роботі
з кислотами і солями;
знати якісну реакцію на
сульфат – йони, удосконалити
уміння писати рівняння реакцій
йонного обміну;
сформувати уміння розв'язувати
задачі за хімічними рівняннями
в разі надлишку одного з реагентів;
підвищити пізнавальний інтерес до вивчення хімії шляхом ознайомлення з цікавими фактами, природними мінералами та дослідами
розвивати логічне мислення
Слайд #2
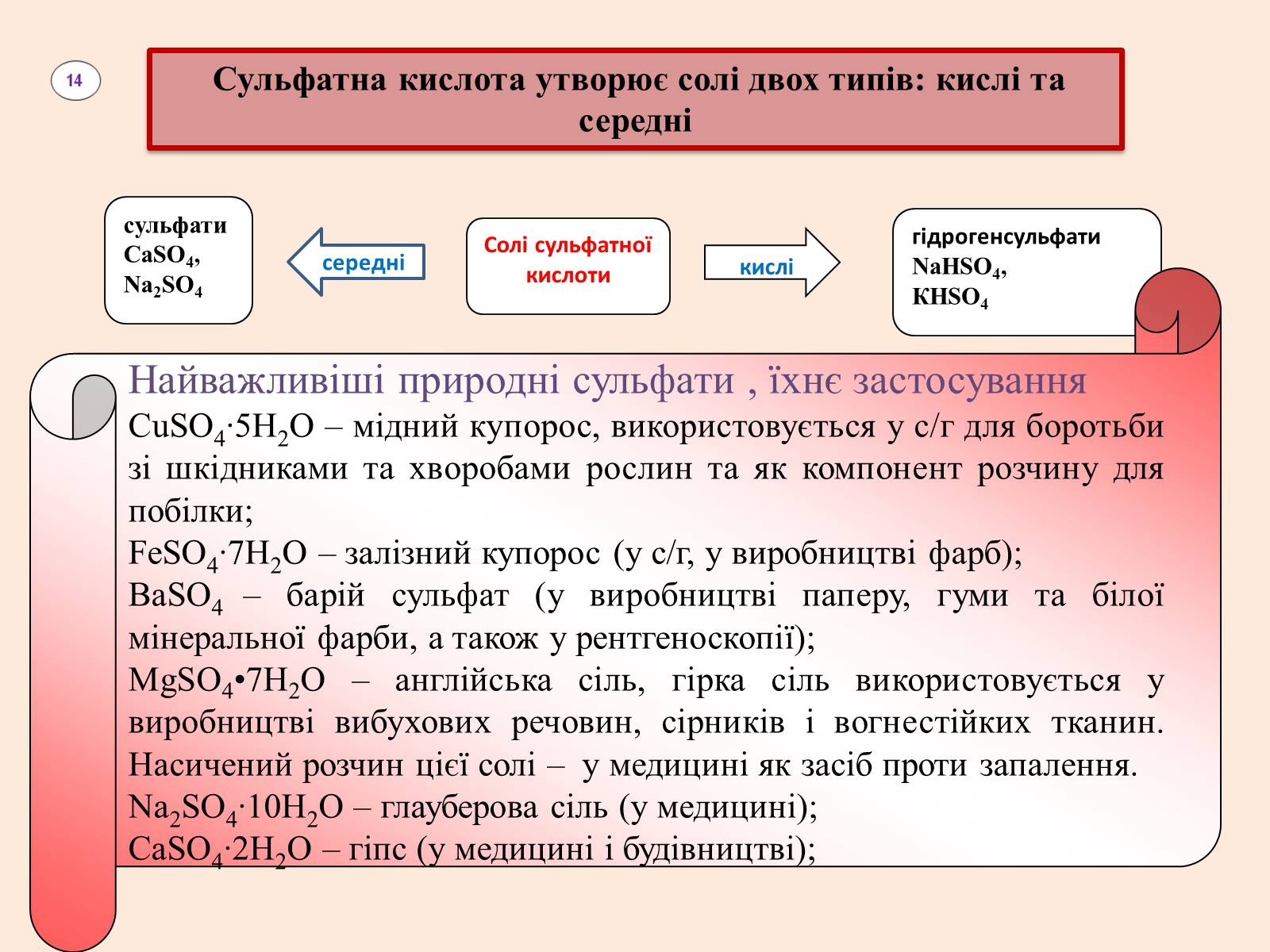
Сульфатна кислота утворює солі двох типів: кислі та середні
сульфати
СаSO4, Na2SO4
середні
Солі сульфатної кислоти
кислі
гідрогенсульфати
NaHSO4,
КHSO4
Найважливіші природні сульфати , їхнє застосування
СuSO4∙5Н2O – мідний купорос, використовується у с/г для боротьби зі шкідниками та хворобами рослин та як компонент розчину для побілки;
FeSO4∙7Н2O – залізний купорос (у с/г, у виробництві фарб);
ВаSO4 – барій сульфат (у виробництві паперу, гуми та білої мінеральної фарби, а також у рентгеноскопії);
MgSO4•7H2O – англійська сіль, гірка сіль використовується у виробництві вибухових речовин, сірників і вогнестійких тканин. Насичений розчин цієї солі – у медицині як засіб проти запалення.
Na2SO4∙10Н2O – глауберова сіль (у медицині);
СаSO4∙2Н2O – гіпс (у медицині і будівництві);
сульфати
СаSO4, Na2SO4
середні
Солі сульфатної кислоти
кислі
гідрогенсульфати
NaHSO4,
КHSO4
Найважливіші природні сульфати , їхнє застосування
СuSO4∙5Н2O – мідний купорос, використовується у с/г для боротьби зі шкідниками та хворобами рослин та як компонент розчину для побілки;
FeSO4∙7Н2O – залізний купорос (у с/г, у виробництві фарб);
ВаSO4 – барій сульфат (у виробництві паперу, гуми та білої мінеральної фарби, а також у рентгеноскопії);
MgSO4•7H2O – англійська сіль, гірка сіль використовується у виробництві вибухових речовин, сірників і вогнестійких тканин. Насичений розчин цієї солі – у медицині як засіб проти запалення.
Na2SO4∙10Н2O – глауберова сіль (у медицині);
СаSO4∙2Н2O – гіпс (у медицині і будівництві);
Слайд #3
Сульфатна кислота утворює солі двох типів: кислі та середні
сульфати
СаSO4, Na2SO4
середні
Солі сульфатної кислоти
кислі
гідрогенсульфати
NaHSO4,
КHSO4
Найважливіші природні сульфати , їхнє застосування
СuSO4∙5Н2O – мідний купорос, використовується у с/г для боротьби зі шкідниками та хворобами рослин та як компонент розчину для побілки;
FeSO4∙7Н2O – залізний купорос (у с/г, у виробництві фарб);
ВаSO4 – барій сульфат (у виробництві паперу, гуми та білої мінеральної фарби, а також у рентгеноскопії);
MgSO4•7H2O – англійська сіль, гірка сіль використовується у виробництві вибухових речовин, сірників і вогнестійких тканин. Насичений розчин цієї солі – у медицині як засіб проти запалення.
Na2SO4∙10Н2O – глауберова сіль (у медицині);
СаSO4∙2Н2O – гіпс (у медицині і будівництві);
сульфати
СаSO4, Na2SO4
середні
Солі сульфатної кислоти
кислі
гідрогенсульфати
NaHSO4,
КHSO4
Найважливіші природні сульфати , їхнє застосування
СuSO4∙5Н2O – мідний купорос, використовується у с/г для боротьби зі шкідниками та хворобами рослин та як компонент розчину для побілки;
FeSO4∙7Н2O – залізний купорос (у с/г, у виробництві фарб);
ВаSO4 – барій сульфат (у виробництві паперу, гуми та білої мінеральної фарби, а також у рентгеноскопії);
MgSO4•7H2O – англійська сіль, гірка сіль використовується у виробництві вибухових речовин, сірників і вогнестійких тканин. Насичений розчин цієї солі – у медицині як засіб проти запалення.
Na2SO4∙10Н2O – глауберова сіль (у медицині);
СаSO4∙2Н2O – гіпс (у медицині і будівництві);
Слайд #4
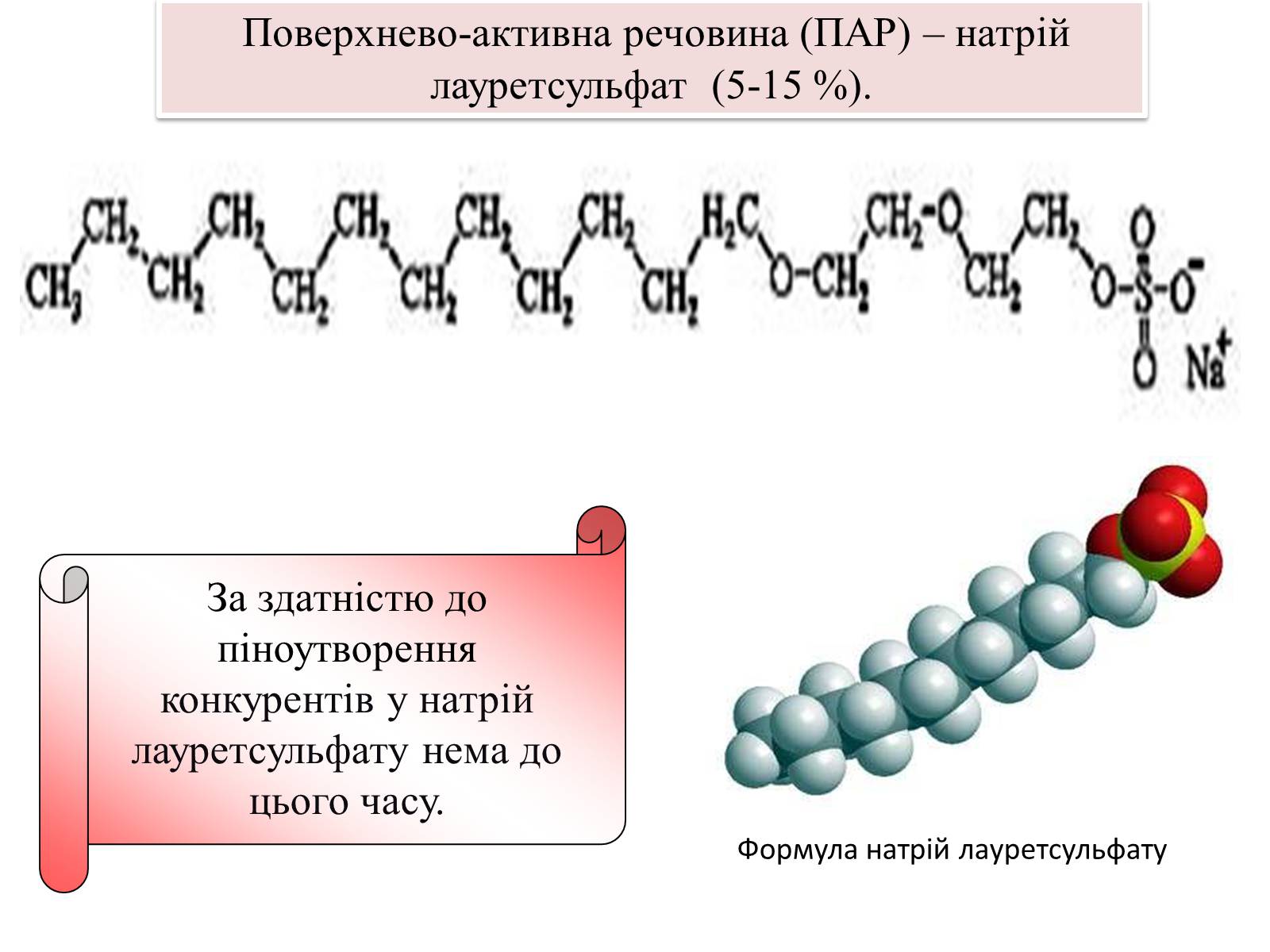
Формула натрій лауретсульфату
За здатністю до піноутворення конкурентів у натрій лауретсульфату нема до цього часу.
Поверхнево-активна речовина (ПАР) – натрій лауретсульфат (5-15 %).
За здатністю до піноутворення конкурентів у натрій лауретсульфату нема до цього часу.
Поверхнево-активна речовина (ПАР) – натрій лауретсульфат (5-15 %).
Слайд #5
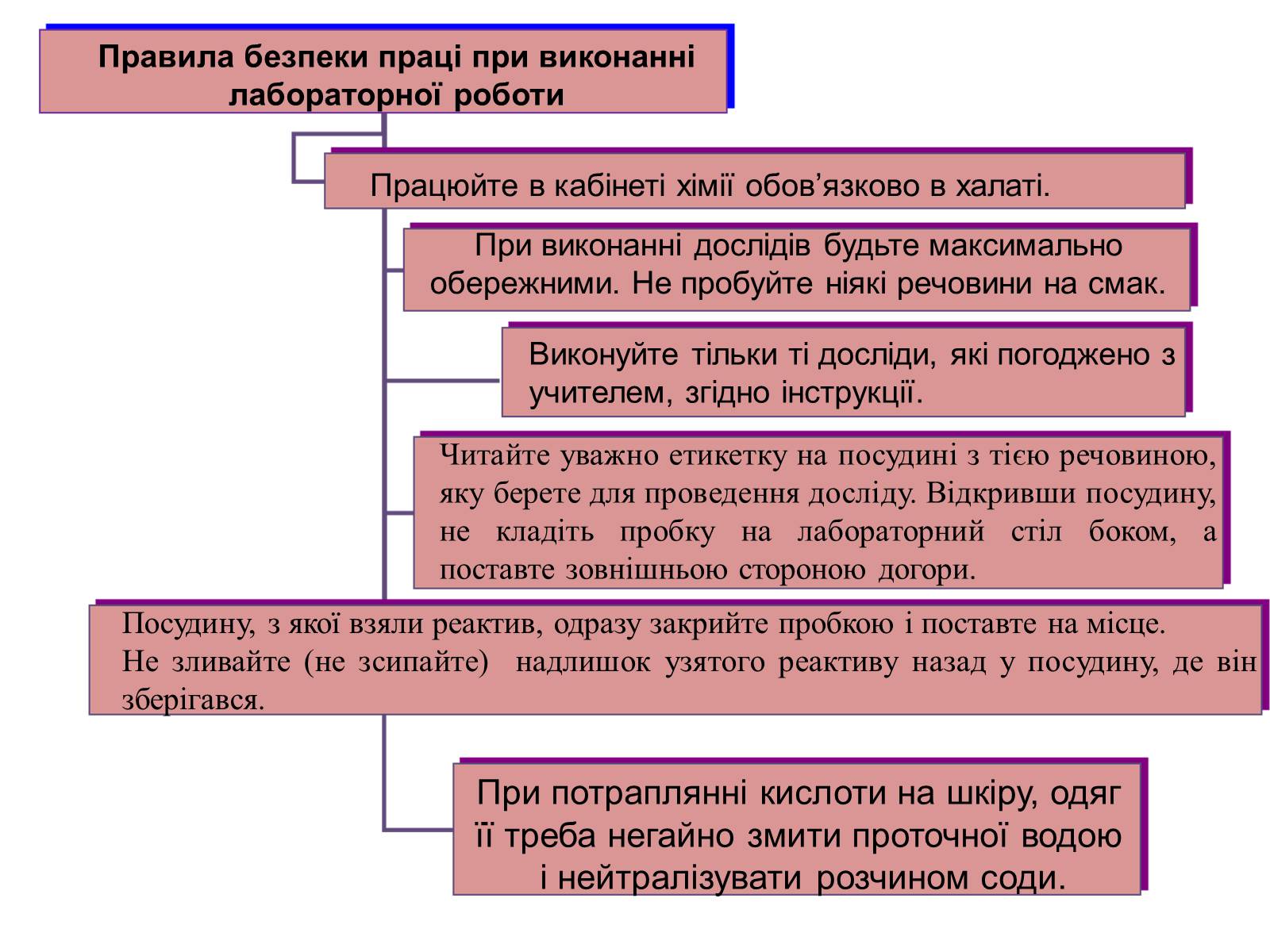
Правила безпеки праці при виконанні лабораторної роботи
Працюйте в кабінеті хімії обов'язково в халаті.
При виконанні дослідів будьте максимально обережними. Не пробуйте ніякі речовини на смак.
Виконуйте тільки ті досліди, які погоджено з учителем, згідно інструкції.
Читайте уважно етикетку на посудині з тією речовиною, яку берете для проведення досліду. Відкривши посудину, не кладіть пробку на лабораторний стіл боком, а поставте зовнішньою стороною догори.
Посудину, з якої взяли реактив, одразу закрийте пробкою і поставте на місце.
Не зливайте (не зсипайте) надлишок узятого реактиву назад у посудину, де він зберігався.
При потраплянні кислоти на шкіру, одяг
її треба негайно змити проточної водою
і нейтралізувати розчином соди.
Працюйте в кабінеті хімії обов'язково в халаті.
При виконанні дослідів будьте максимально обережними. Не пробуйте ніякі речовини на смак.
Виконуйте тільки ті досліди, які погоджено з учителем, згідно інструкції.
Читайте уважно етикетку на посудині з тією речовиною, яку берете для проведення досліду. Відкривши посудину, не кладіть пробку на лабораторний стіл боком, а поставте зовнішньою стороною догори.
Посудину, з якої взяли реактив, одразу закрийте пробкою і поставте на місце.
Не зливайте (не зсипайте) надлишок узятого реактиву назад у посудину, де він зберігався.
При потраплянні кислоти на шкіру, одяг
її треба негайно змити проточної водою
і нейтралізувати розчином соди.
Слайд #6
Дано: Розв'язання
m(Na) = 9,2 г 1. З'ясовуємо, чи повністю вступить у реакцію кожна
m(Cl2) = 35,5 г тобто, яка речовина в недостачі, а яка у надлишку.
m(NaCl) — ? Визначаємо кількості речовини натрію і хлору:
m (Na) 9,2 г
n(Na) = ————= —————= 0,4 моль;
M(Na) 23 г/моль
m(Cl2) 35,5 г
n(Cl2) = ————= —————= 0,5 моль.
M(Cl2 ) 71 г/моль
Згідно з хімічним рівнянням
Х моль
0,4моль 0,5моль у г
2Na + Cl2 = 2NaCl
2 моль 1моль 2моль
58,5 г/моль
117 г
Х= = 0,2 моль - n(СІ2, яка
потрібна для реакції з 0,4моль Na). А є 0,5 моль СІ2.
Отже СІ2 – в надлишку, а Na – в недостачі.
речовина,
m(Na) = 9,2 г 1. З'ясовуємо, чи повністю вступить у реакцію кожна
m(Cl2) = 35,5 г тобто, яка речовина в недостачі, а яка у надлишку.
m(NaCl) — ? Визначаємо кількості речовини натрію і хлору:
m (Na) 9,2 г
n(Na) = ————= —————= 0,4 моль;
M(Na) 23 г/моль
m(Cl2) 35,5 г
n(Cl2) = ————= —————= 0,5 моль.
M(Cl2 ) 71 г/моль
Згідно з хімічним рівнянням
Х моль
0,4моль 0,5моль у г
2Na + Cl2 = 2NaCl
2 моль 1моль 2моль
58,5 г/моль
117 г
Х= = 0,2 моль - n(СІ2, яка
потрібна для реакції з 0,4моль Na). А є 0,5 моль СІ2.
Отже СІ2 – в надлишку, а Na – в недостачі.
речовина,

Слайд #7
2. Масу продукту реакції знаходимо за речовиною, яка в
недостачі:
у=
= 23,4 г – m(NaCl).
0,4моль 0,5моль у г
2Na + Cl2 = 2NaCl
2 моль 1моль 2моль
58,5 г/моль
117 г
;
ДОМАШНЄ ЗАВДАННЯ:
питання вивчити - §9;
,
ст. 71 №85- 87, ст. 54 №62-65 виконати у домашньому зошиті.
недостачі:
у=
= 23,4 г – m(NaCl).
0,4моль 0,5моль у г
2Na + Cl2 = 2NaCl
2 моль 1моль 2моль
58,5 г/моль
117 г
;
ДОМАШНЄ ЗАВДАННЯ:
питання вивчити - §9;
,
ст. 71 №85- 87, ст. 54 №62-65 виконати у домашньому зошиті.

Слайд #8
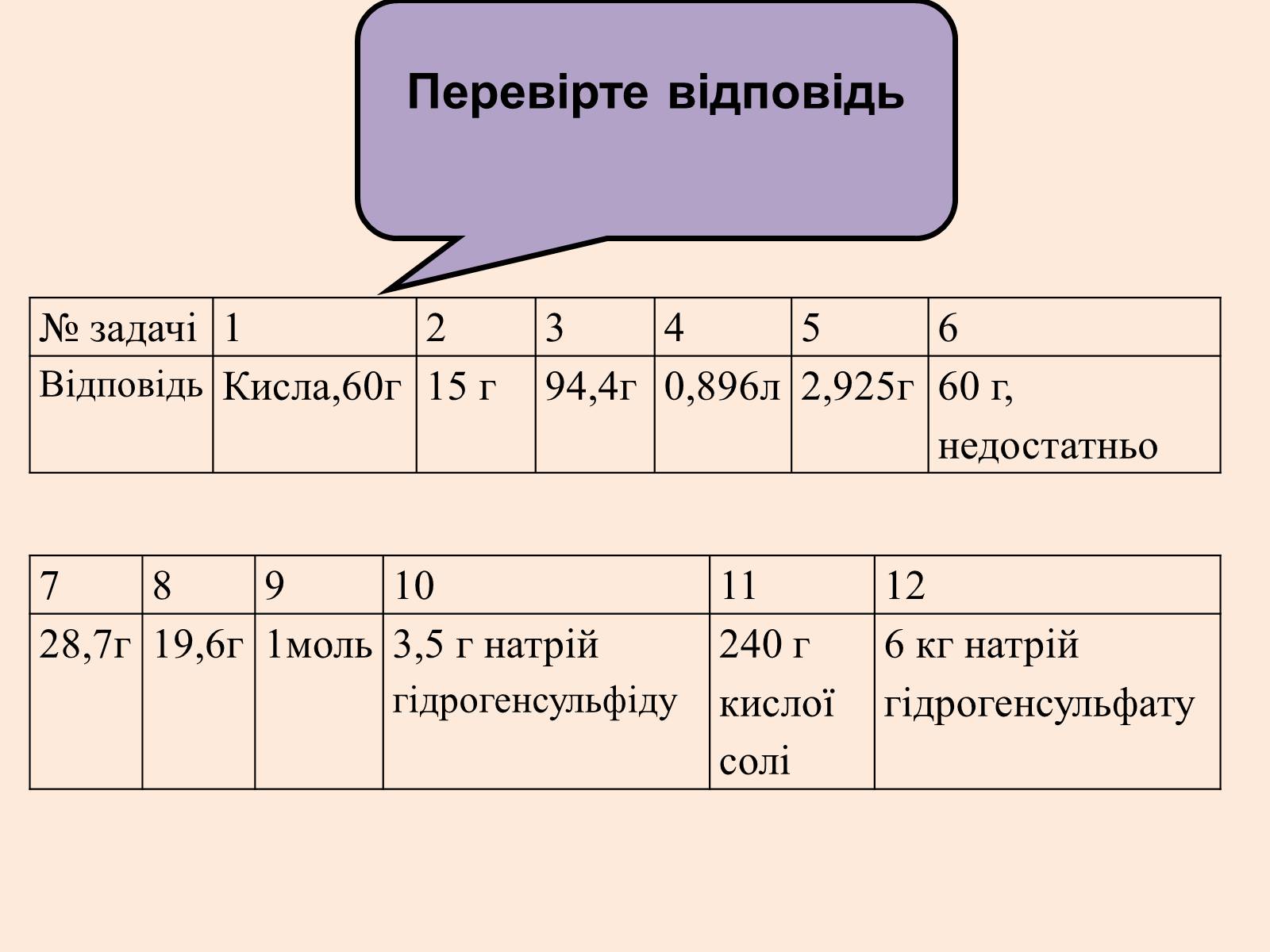
№ задачі
1
2
3
4
5
6
Відповідь
Кисла,60г
15 г
94,4г
0,896л
2,925г
60 г, недостатньо
7
8
9
10
11
12
28,7г
19,6г
1моль
3,5 г натрій гідрогенсульфіду
240 г кислої
солі
6 кг натрій гідрогенсульфату
Перевірте відповідь
1
2
3
4
5
6
Відповідь
Кисла,60г
15 г
94,4г
0,896л
2,925г
60 г, недостатньо
7
8
9
10
11
12
28,7г
19,6г
1моль
3,5 г натрій гідрогенсульфіду
240 г кислої
солі
6 кг натрій гідрогенсульфату
Перевірте відповідь
Слайд #9
Підсумки уроку. Сьогодні на уроці:
Я дізналася
(дізнався)…
Я навчився
(навчилася)…
Мене здивував
той факт…
Я дізналася
(дізнався)…
Я навчився
(навчилася)…
Мене здивував
той факт…