- Головна
- Готові шкільні презентації
- Презентація на тему «Алюміній» (варіант 1)
Презентація на тему «Алюміній» (варіант 1)
268
Слайд #1
Алюміній.
Алюміній оксид, алюміній гідроксид, їх амфотерність.
Солі Алюмінію. Використання найважливіших сполук Алюмінію.
Алюміній оксид, алюміній гідроксид, їх амфотерність.
Солі Алюмінію. Використання найважливіших сполук Алюмінію.

Слайд #2
Я сріблястий, я криластий,
Високо люблю літати.
А корозії не знаю,
Плівкою себе вкриваю.
На опорах через ліс
То дротами я повис.
Можу двері змайструвати,
Посудом на кухні стати.
А народжуюсь із глини.
Чи мене назвеш ти нині?
Високо люблю літати.
А корозії не знаю,
Плівкою себе вкриваю.
На опорах через ліс
То дротами я повис.
Можу двері змайструвати,
Посудом на кухні стати.
А народжуюсь із глини.
Чи мене назвеш ти нині?

Слайд #3
Назва “алюміній” походить від лат. Alumen (aluminis) – “галуни” у зв'язку із застосуванням останніх як протиотрути під час фарбування тканин і як засобу для припинення кровотечі; алюмокалієві галуни - перші сполуки Алюмінію, що знайшли практичне застосування.
Історична довідка
Історична довідка

Слайд #4
Геродот(V ст. до н.е.)
Галуни відомі з давніх часів. За словами грецького історика Геродота, давні народи застосовували під час фарбування тканин для закріплення їх кольору мінеральну породу, яку називали “алюмен”, тобто “та, що в'яже”. Цією породою і були галуни.
Галуни відомі з давніх часів. За словами грецького історика Геродота, давні народи застосовували під час фарбування тканин для закріплення їх кольору мінеральну породу, яку називали “алюмен”, тобто “та, що в'яже”. Цією породою і були галуни.

Слайд #5
Імператор Тиберій
Одного разу до імператора Тиберія прийшов незнайомець. В дар імператору він приніс виготовлену ним чашу з блискучого, неначе срібло, проте надзвичайно легкого матеріалу. Побоюючись, що новий метал з його чудовими властивостями знецінить золото та срібло, Тиберій наказав відрубати винахіднику голову, а його майстерню зруйнувати.
Одного разу до імператора Тиберія прийшов незнайомець. В дар імператору він приніс виготовлену ним чашу з блискучого, неначе срібло, проте надзвичайно легкого матеріалу. Побоюючись, що новий метал з його чудовими властивостями знецінить золото та срібло, Тиберій наказав відрубати винахіднику голову, а його майстерню зруйнувати.

Слайд #6
Парацельс
Лише в ХVІ столітті до історії алюмінію була вписана нова сторінка. Це зробив німецький лікар Парацельс Філіпп Ауреол Теофраст Бомбаст фон Гогенхайм (Гогенгейм).
Досліджуючи різні матеріали, у тому числі галуни, Парацельс установив, що вони “ є сіллю якоїсь галунової землі ”, до складу якої входить оксид невідомого металу, в подальшому названого глинозем.
Лише в ХVІ столітті до історії алюмінію була вписана нова сторінка. Це зробив німецький лікар Парацельс Філіпп Ауреол Теофраст Бомбаст фон Гогенхайм (Гогенгейм).
Досліджуючи різні матеріали, у тому числі галуни, Парацельс установив, що вони “ є сіллю якоїсь галунової землі ”, до складу якої входить оксид невідомого металу, в подальшому названого глинозем.

Слайд #7
Г.К. Ерстед
Першим, кому вдалось одержати металічний алюміній, був датський учений Г.К.Ерстед. У 1825 році Ерстед отримав алюміній з бокситу
(Al2O3 + домішки).
До винайдення способу одержання алюмінію методом електролізу вартість його була дуже високою. На Всесвітній виставці в Парижі в 1855 році алюміній демонструвався як матеріал для виготовлення ювелірних виробів. У 1889 році Менделєєву в Лондоні подарували, як особливо цінний подарунок, терези, виготовлені з алюмінію.
Першим, кому вдалось одержати металічний алюміній, був датський учений Г.К.Ерстед. У 1825 році Ерстед отримав алюміній з бокситу
(Al2O3 + домішки).
До винайдення способу одержання алюмінію методом електролізу вартість його була дуже високою. На Всесвітній виставці в Парижі в 1855 році алюміній демонструвався як матеріал для виготовлення ювелірних виробів. У 1889 році Менделєєву в Лондоні подарували, як особливо цінний подарунок, терези, виготовлені з алюмінію.

Слайд #8
Фрідріх Веллер
У 1827 році німецький хімік Фрідріх Веллер одержав алюміній простішим способом. Він використав металічний калій замість амальгами калію для відновлення алюмінію. Веллер одержав метал у вигляді порошку.
Al2O3 + 3Cl2 + 3C 2AlCl3 + 3CO
AlCl3 + 3KHg 3KCl + AlHg3x
AlHg3x Al + 3x Hg
t
У 1827 році німецький хімік Фрідріх Веллер одержав алюміній простішим способом. Він використав металічний калій замість амальгами калію для відновлення алюмінію. Веллер одержав метал у вигляді порошку.
Al2O3 + 3Cl2 + 3C 2AlCl3 + 3CO
AlCl3 + 3KHg 3KCl + AlHg3x
AlHg3x Al + 3x Hg
t

Слайд #9
Для становлення вітчизняної алюмінієвої промисловості велике значення мали дослідження члена-кореспондента АН СРСР О.О. Яковкіна (1860-1936), який розробив методи одержання чистого оксиду алюмінію з бокситів, глин і нефелінів. В Україні вперше одержали алюміній у 1933 році на Дніпропетровському алюмінієвому заводі.

Слайд #10
Основними способами
одержання алюмінію
на сьогоднішній день є електроліз. Хоча вчені знайшли в Китаї гробницю полководця Чжоу Чжу (помер на початку ІІІ ст.), зроблену зі сплаву, що містить 85% алюмінію. Це свідчить про те, що існував інший спосіб одержання алюмінію, який було втрачено.
одержання алюмінію
на сьогоднішній день є електроліз. Хоча вчені знайшли в Китаї гробницю полководця Чжоу Чжу (помер на початку ІІІ ст.), зроблену зі сплаву, що містить 85% алюмінію. Це свідчить про те, що існував інший спосіб одержання алюмінію, який було втрачено.

Слайд #11
Основними способами
одержання алюмінію
на сьогоднішній день є електроліз. Хоча вчені знайшли в Китаї гробницю полководця Чжоу Чжу (помер на початку ІІІ ст.), зроблену зі сплаву, що містить 85% алюмінію. Це свідчить про те, що існував інший спосіб одержання алюмінію, який було втрачено.
одержання алюмінію
на сьогоднішній день є електроліз. Хоча вчені знайшли в Китаї гробницю полководця Чжоу Чжу (помер на початку ІІІ ст.), зроблену зі сплаву, що містить 85% алюмінію. Це свідчить про те, що існував інший спосіб одержання алюмінію, який було втрачено.
Слайд #12
Польовий шпат Al2O3;
Боксит Al2O3 ∙nH2O;
Нефелін Al2O3 ∙Na2O∙2SiO2,
або NaAlSiO4;
Корунд (прозорі кристали) Al2O3;
Каолін (глина) Al2O3 ∙2SiO2∙2H2O;
Гідроаргеліт Al(OH)3;
Беміт AlO(OH);
Діаспор HAlO2;
Кріоліт Na3AlF6;
Алюмінієві галуни KAl(SO)4∙12H2O
Найважливіші природні сполуки Алюмінію
Боксит Al2O3 ∙nH2O;
Нефелін Al2O3 ∙Na2O∙2SiO2,
або NaAlSiO4;
Корунд (прозорі кристали) Al2O3;
Каолін (глина) Al2O3 ∙2SiO2∙2H2O;
Гідроаргеліт Al(OH)3;
Беміт AlO(OH);
Діаспор HAlO2;
Кріоліт Na3AlF6;
Алюмінієві галуни KAl(SO)4∙12H2O
Найважливіші природні сполуки Алюмінію

Слайд #13
Періодична система хімічних елементів Д.І.Менделєєва
Періоди
1
2
3
4
5
6
7
Ряди
1
2
3
4
10
9
8
7
5
6
Групи елементів
I
II
VI
V
VII
III
IV
VIII
Характеристика
1.
Вперше добуто в 1825 році Гансом Ерстедом.
2.
У Періодичній системі знаходиться в 3 періоді, III група, головна підгрупа.
3.
У природі зустрічається тільки у вигляді сполук.
4.
Сріблясто-білий, легкий метал. Має високі тепло - та електропровідність.
5.
Валентність: III.
Ступінь окиснення: +3.
27
+13
Al
Періоди
1
2
3
4
5
6
7
Ряди
1
2
3
4
10
9
8
7
5
6
Групи елементів
I
II
VI
V
VII
III
IV
VIII
Характеристика
1.
Вперше добуто в 1825 році Гансом Ерстедом.
2.
У Періодичній системі знаходиться в 3 періоді, III група, головна підгрупа.
3.
У природі зустрічається тільки у вигляді сполук.
4.
Сріблясто-білий, легкий метал. Має високі тепло - та електропровідність.
5.
Валентність: III.
Ступінь окиснення: +3.
27
+13
Al

Слайд #14
Алюміній
Al
27
+13
2
8
3
P = 13
e = 13
N = 14
−
Короткий електронний запис:
1s²
2p⁶
3p
1
2s²
3s²
Al
27
+13
2
8
3
P = 13
e = 13
N = 14
−
Короткий електронний запис:
1s²
2p⁶
3p
1
2s²
3s²

Слайд #15
сріблясто – білий метал;
ковкий;
легко витягується;
tпл = 660 0С;
tкип = 2520 0С;
ρ = 22,7 г/см3;
За кімнатної температури Al не змінюється, його поверхня вкрита тонкою оксидною плівкою.
Фізичні властивості Алюмінію:
ковкий;
легко витягується;
tпл = 660 0С;
tкип = 2520 0С;
ρ = 22,7 г/см3;
За кімнатної температури Al не змінюється, його поверхня вкрита тонкою оксидною плівкою.
Фізичні властивості Алюмінію:

Слайд #16
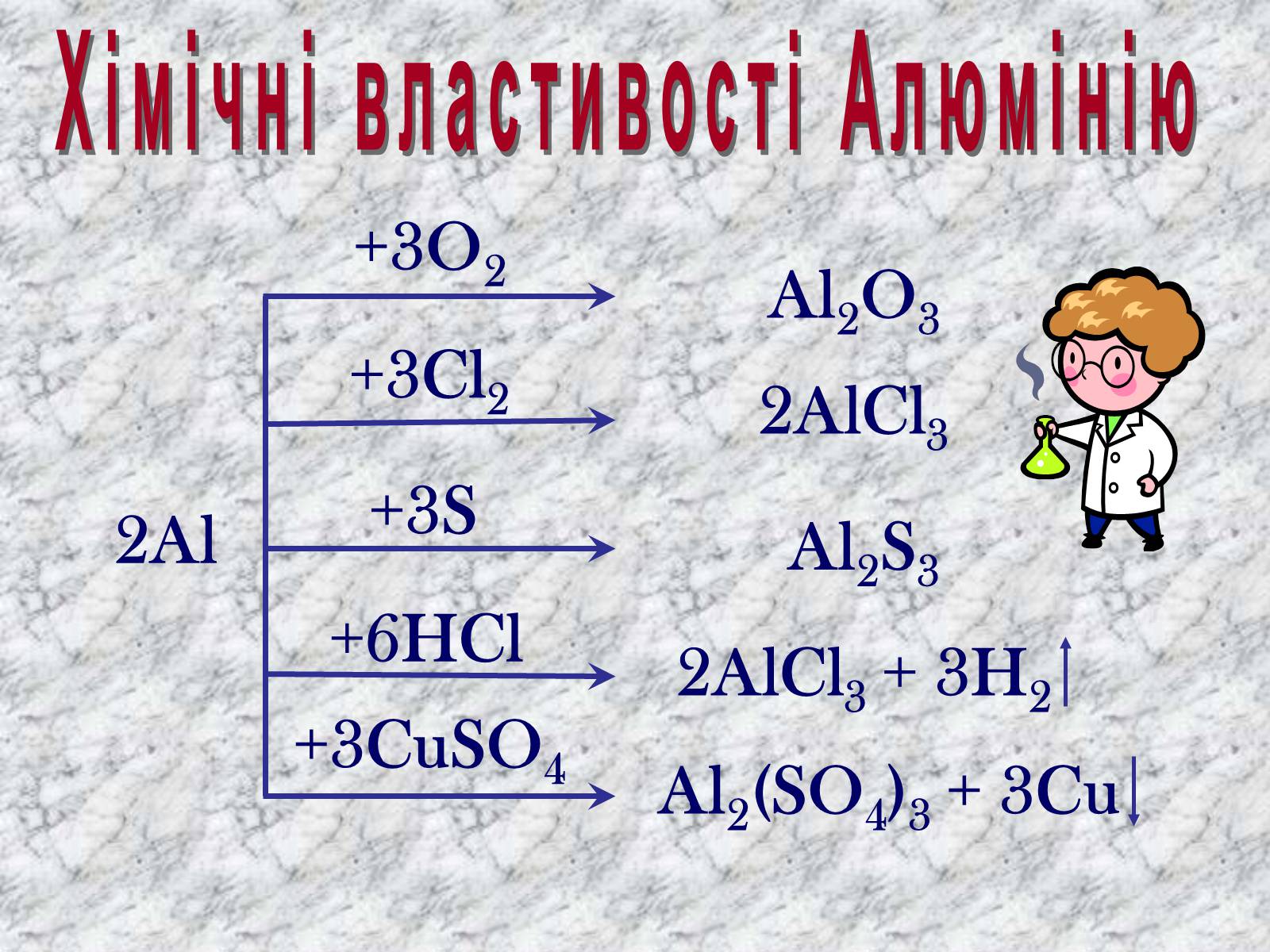
Хімічні властивості Алюмінію
2Al
+3O2
Al2O3
+3Cl2
2AlCl3
+3S
Al2S3
+6HCl
2AlCl3 + 3H2
+3CuSO4
Al2(SO4)3 + 3Cu
2Al
+3O2
Al2O3
+3Cl2
2AlCl3
+3S
Al2S3
+6HCl
2AlCl3 + 3H2
+3CuSO4
Al2(SO4)3 + 3Cu
Слайд #17
Алюміній є амфотерним елементом:
взаємодіє с кислотами та лугами.
2Al + 6HCl(розбавлена) = 2AlCl3 + 3H2
8Al + 15H2SO4(конц.) 4Al2(SO4)3 + 3H2S + 12H2O
Al + 6HNO3 (конц.) Al(NO3)3 + 3NO2 + 3H2O
2Al + 6NaOH 2Na3AlO3 + 3H2
2Al + 2NaOH + 6H2O = 2Na[Al(OН)4] + 3H2
2Al + 6NaOH(надлишок) + 6H2O = 2 Na3[Al(OH)6] + 3H2
t
t
t
взаємодіє с кислотами та лугами.
2Al + 6HCl(розбавлена) = 2AlCl3 + 3H2
8Al + 15H2SO4(конц.) 4Al2(SO4)3 + 3H2S + 12H2O
Al + 6HNO3 (конц.) Al(NO3)3 + 3NO2 + 3H2O
2Al + 6NaOH 2Na3AlO3 + 3H2
2Al + 2NaOH + 6H2O = 2Na[Al(OН)4] + 3H2
2Al + 6NaOH(надлишок) + 6H2O = 2 Na3[Al(OH)6] + 3H2
t
t
t

Слайд #18
Оксид та гідроксид алюмінію також мають амфотерні властивості:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
2Al(OH)3 + 6HCl = 2AlCl3 + 6H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O (у процесі сплавлення)
Al(OH)3 + NaOH = Na[Al(OH)4] (у розчинах)
Хімічні властивості сполук Алюмінію
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
2Al(OH)3 + 6HCl = 2AlCl3 + 6H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O (у процесі сплавлення)
Al(OH)3 + NaOH = Na[Al(OH)4] (у розчинах)
Хімічні властивості сполук Алюмінію

Слайд #19
Алюміній утворює солі двох типів. У сполуках AlCl3, Al2(SO4)3, AlPO4 містяться катіони цього елемента, а в солях NaAlO2, Ca3(AlO3)2 він входить до складу аніонів кислотних залишків.
При охолодженні насичених розчинів хлориду, сульфату і нітрату Алюмінію або випаровуванні води із них виділяються безбарвні кристалогідрати AlCl3∙6H2O, Al2(SO4)3 ∙18H2O і Al(NO3)3 ∙9H2O.
У насиченому розчині сульфатів
Алюмінію і Калію можна виростити
кристали “ подвійної ” солі
К2SO4∙ Al2(SO4)3 ∙24H2O. Її тривіальна
назва – алюмокалієвий галун.
Солі Алюмінію
При охолодженні насичених розчинів хлориду, сульфату і нітрату Алюмінію або випаровуванні води із них виділяються безбарвні кристалогідрати AlCl3∙6H2O, Al2(SO4)3 ∙18H2O і Al(NO3)3 ∙9H2O.
У насиченому розчині сульфатів
Алюмінію і Калію можна виростити
кристали “ подвійної ” солі
К2SO4∙ Al2(SO4)3 ∙24H2O. Її тривіальна
назва – алюмокалієвий галун.
Солі Алюмінію

Слайд #20
Алюміній дуже добре проводить електричний струм – за електропровідністю він іде після срібла та міді. Тому з чистого алюмінію виготовляють електропроводи.
Алюмінієве покриття добре захищає стальні та чавунні вироби від корозії. Для цього поверхню таких виробів насичують алюмінієм – алітують.
Сплавам алюмінію з міддю, магнієм, силіцієм властиві легкість та висока міцність, тому вони використовуються в авіації, суднобудуванні, залізничному транспорті, у будівництві, приладобудуванні.
Алюміній застосовують для одержання
металів і неметалів.
Застосування Алюмінію та його сполук
Алюмінієве покриття добре захищає стальні та чавунні вироби від корозії. Для цього поверхню таких виробів насичують алюмінієм – алітують.
Сплавам алюмінію з міддю, магнієм, силіцієм властиві легкість та висока міцність, тому вони використовуються в авіації, суднобудуванні, залізничному транспорті, у будівництві, приладобудуванні.
Алюміній застосовують для одержання
металів і неметалів.
Застосування Алюмінію та його сполук

Слайд #21
Алюміній

Слайд #22
Корунд

Слайд #23
Коштовні різновиди корунду

Слайд #24
Зварювання рейок
за допомогою
термітної суміші
за допомогою
термітної суміші
