- Головна
- Готові шкільні презентації
- Презентація на тему «Корозія металів» (варіант 5)
Презентація на тему «Корозія металів» (варіант 5)
273
Слайд #1
Корозія металів
Виконалаучениця 10-А класуНовоград-Волинської ЗОШ №7Бучинська Дарія
Виконалаучениця 10-А класуНовоград-Волинської ЗОШ №7Бучинська Дарія

Слайд #2
КОРОЗІЯ - мимовільне руйнування металів і сплавів в результаті хімічної або електрохімічної взаємодії їх з довкіллям.

Слайд #3
ВПЛИВ КОРОЗІЇ:
Викликає серйозні екологічні наслідки: витік нафти, газу, інших хімічних продуктів.
Недопустима у багатьох галузях промисловості : авіаційної, хімічного, нафтового і атомного машинобудування.
Негативно впливає на життя і здоров'я людей.
Викликає серйозні екологічні наслідки: витік нафти, газу, інших хімічних продуктів.
Недопустима у багатьох галузях промисловості : авіаційної, хімічного, нафтового і атомного машинобудування.
Негативно впливає на життя і здоров'я людей.

Слайд #4
ЧИННИКИ, ЩО ВИКЛИКАЮТЬ КОРОЗІЮ
кисень і волога атмосфери;
вуглекислий і сірчистий гази, що містяться в атмосфері;
морська вода;
ґрунтові води.
кисень і волога атмосфери;
вуглекислий і сірчистий гази, що містяться в атмосфері;
морська вода;
ґрунтові води.

Слайд #5
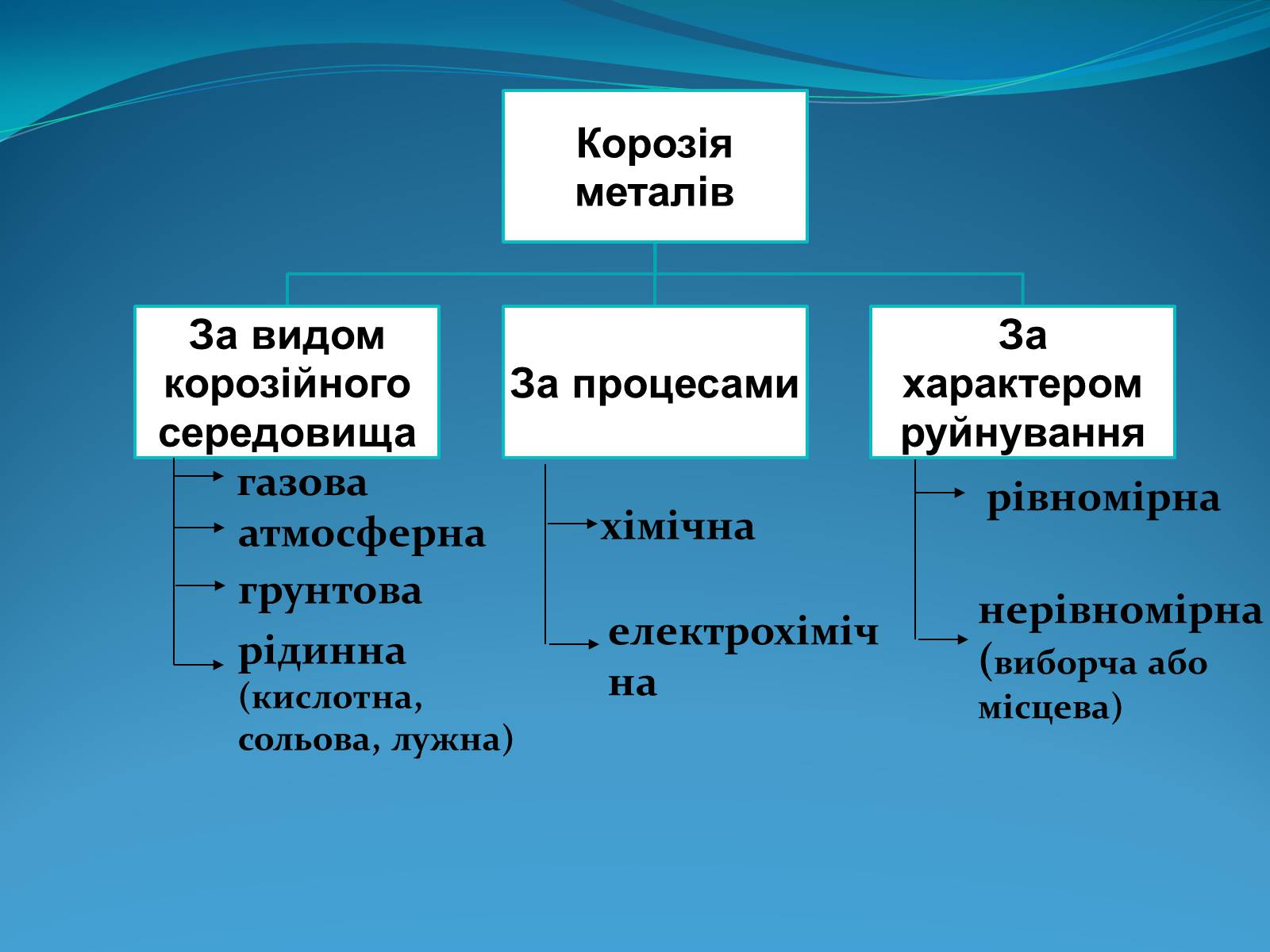
газова
атмосферна
грунтова
рідинна (кислотна, сольова, лужна)
хімічна
електрохімічна
рівномірна
нерівномірна (виборча або місцева)
атмосферна
грунтова
рідинна (кислотна, сольова, лужна)
хімічна
електрохімічна
рівномірна
нерівномірна (виборча або місцева)
Слайд #6
Існує два види корозії: хімічна і електрохімічна.
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.
ВИДИ КОРОЗІЇ
Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей.
Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.
ВИДИ КОРОЗІЇ

Слайд #7
ХІМІЧНА КОРОЗІЯ
Відбувається в середовищах, які не проводять електричного струму. Вона обумовлюється дією на метали неелектролітів (спирту, бензину, мінеральних масел тощо) і сухих газів (кисню, оксидів азоту, хлору, хлороводню, сірководню і ін.) при високій температурі (так звана газова корозія).
У результаті взаємодії металів із зовнішнім середовищем їх поверхня вкривається тонким шаром (плівкою) різних хімічних сполук (продуктів корозії): оксидів, хлоридів, сульфідів і т. д. Інколи цей шар такий щільний, що крізь нього не може проникати агресивне середовище. В таких випадках з часом швидкість корозії зменшується, а то й зовсім припиняється.
Відбувається в середовищах, які не проводять електричного струму. Вона обумовлюється дією на метали неелектролітів (спирту, бензину, мінеральних масел тощо) і сухих газів (кисню, оксидів азоту, хлору, хлороводню, сірководню і ін.) при високій температурі (так звана газова корозія).
У результаті взаємодії металів із зовнішнім середовищем їх поверхня вкривається тонким шаром (плівкою) різних хімічних сполук (продуктів корозії): оксидів, хлоридів, сульфідів і т. д. Інколи цей шар такий щільний, що крізь нього не може проникати агресивне середовище. В таких випадках з часом швидкість корозії зменшується, а то й зовсім припиняється.

Слайд #8
ХІМІЧНА КОРОЗІЯ
Наприклад, алюміній в атмосфері повітря кородує значно повільніше від заліза, хоч за своїми хімічними властивостями він активніший від заліза. Це пояснюється тим, що поверхня алюмінію вкривається суцільною, досить щільною і міцною оксидною плівкою, яка ізолює метал від доступу кисню, а оксидна плівка заліза, навпаки, є крихкою і ламкою, містить багато пор і тріщин, через що кисень повітря крізь неї легко проникає до поверхні заліза, і тим обумовлюється безперервне його руйнування.
Наприклад, алюміній в атмосфері повітря кородує значно повільніше від заліза, хоч за своїми хімічними властивостями він активніший від заліза. Це пояснюється тим, що поверхня алюмінію вкривається суцільною, досить щільною і міцною оксидною плівкою, яка ізолює метал від доступу кисню, а оксидна плівка заліза, навпаки, є крихкою і ламкою, містить багато пор і тріщин, через що кисень повітря крізь неї легко проникає до поверхні заліза, і тим обумовлюється безперервне його руйнування.

Слайд #9
УМОВИ, ЯКІ СПРИЯЮТЬ ЕЛЕКТРОХІМІЧНІЙ КОРОЗІЇ
Положення металу у ряді активності металів: чим вони далі розташовані один від одного, тим швидше відбувається корозія.
Чистота металу : домішки прискорюють корозію.
Нерівності поверхні металу, тріщини.
Грунтові води, морська вода, середовище електроліту.
Підвищення температури.
Дія мікроорганізмів(гриби, бактерії і лишайники впливають на метал з високою корозійною стійкістю
Положення металу у ряді активності металів: чим вони далі розташовані один від одного, тим швидше відбувається корозія.
Чистота металу : домішки прискорюють корозію.
Нерівності поверхні металу, тріщини.
Грунтові води, морська вода, середовище електроліту.
Підвищення температури.
Дія мікроорганізмів(гриби, бактерії і лишайники впливають на метал з високою корозійною стійкістю

Слайд #10
ЕЛЕКТРОХІМЧНА КОРОЗІЯ
Вона більш поширена і завдає значно більшої шкоди, ніж хімічна. Вона виникає при контакті двох металів у середовищі водних розчинів електролітів. На відміну від хімічної електрохімічна корозія супроводжується переміщенням валентних електронів з одної ділянки металу на іншу, тобто виникненням місцевих електричних струмів внаслідок утворення на кородуючій поверхні так званих гальванічних пар.
Подвійний електричний шар на границі метал —електроліт
Вона більш поширена і завдає значно більшої шкоди, ніж хімічна. Вона виникає при контакті двох металів у середовищі водних розчинів електролітів. На відміну від хімічної електрохімічна корозія супроводжується переміщенням валентних електронів з одної ділянки металу на іншу, тобто виникненням місцевих електричних струмів внаслідок утворення на кородуючій поверхні так званих гальванічних пар.
Подвійний електричний шар на границі метал —електроліт

Слайд #11
ЕЛЕКТРОХІМІЧНА КОРОЗІЯ
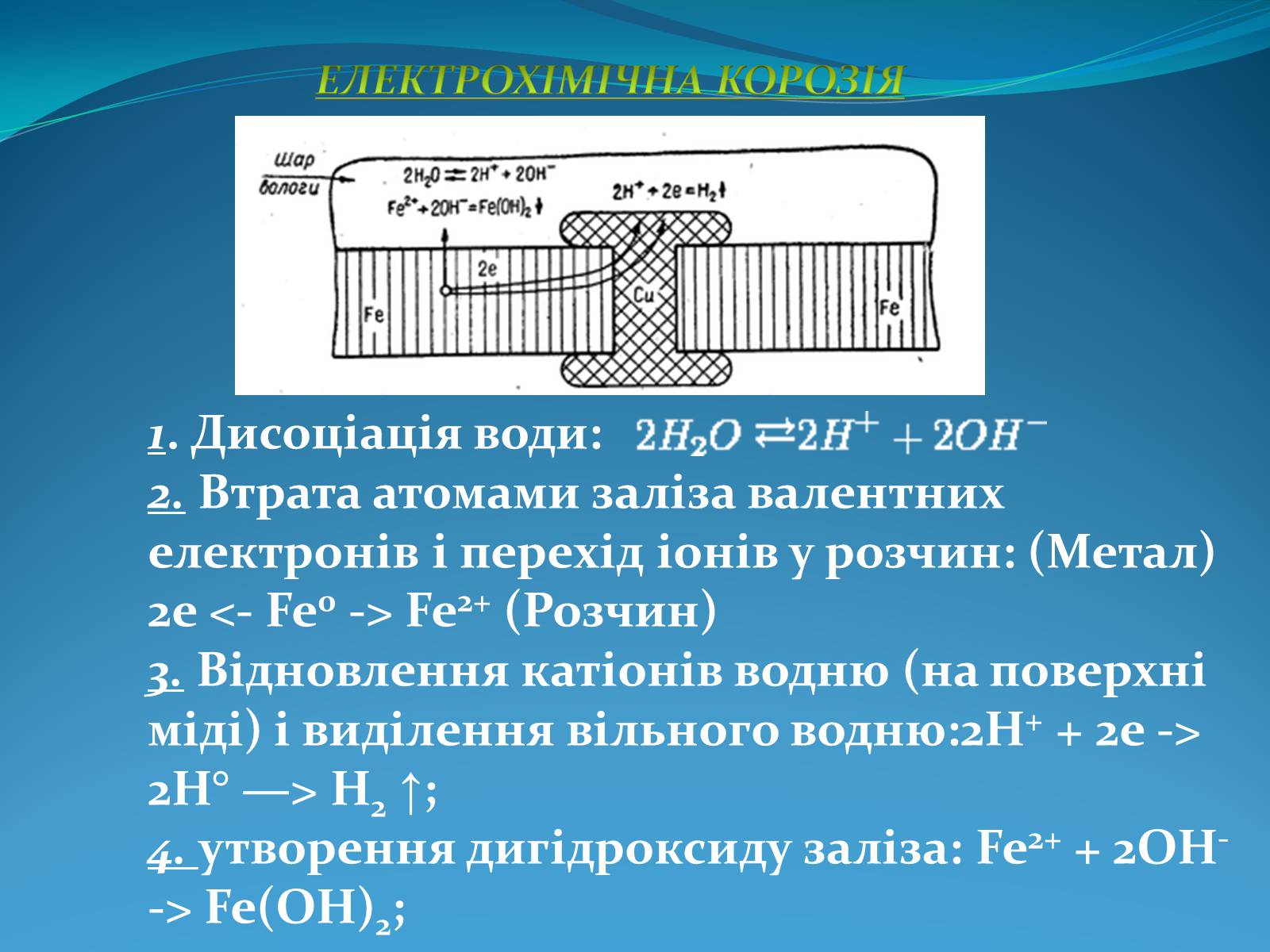
1. Дисоціація води:
2. Втрата атомами заліза валентних електронів і перехід іонів у розчин: (Метал) 2е <- Fe0 -> Fe2+ (Розчин)
3. Відновлення катіонів водню (на поверхні міді) і виділення вільного водню:2Н+ + 2е -> 2Н° —> Н2 ↑;
4. утворення дигідроксиду заліза: Fe2+ + 2OH- -> Fe(OH)2;
1. Дисоціація води:
2. Втрата атомами заліза валентних електронів і перехід іонів у розчин: (Метал) 2е <- Fe0 -> Fe2+ (Розчин)
3. Відновлення катіонів водню (на поверхні міді) і виділення вільного водню:2Н+ + 2е -> 2Н° —> Н2 ↑;
4. утворення дигідроксиду заліза: Fe2+ + 2OH- -> Fe(OH)2;
Слайд #12
ЕЛЕКТРОХІМІЧНА КОРОЗІЯ
5. окиснення двовалентного заліза до тривалентного розчиненим киснем повітря:
6. Fe(OH)2 + O2 + 2H2O -> 4Fe(OH)3;
часткова втрата води тригідроксидом заліза і перетворення його в гідроксид-оксид заліза:
5. окиснення двовалентного заліза до тривалентного розчиненим киснем повітря:
6. Fe(OH)2 + O2 + 2H2O -> 4Fe(OH)3;
часткова втрата води тригідроксидом заліза і перетворення його в гідроксид-оксид заліза:

Слайд #13
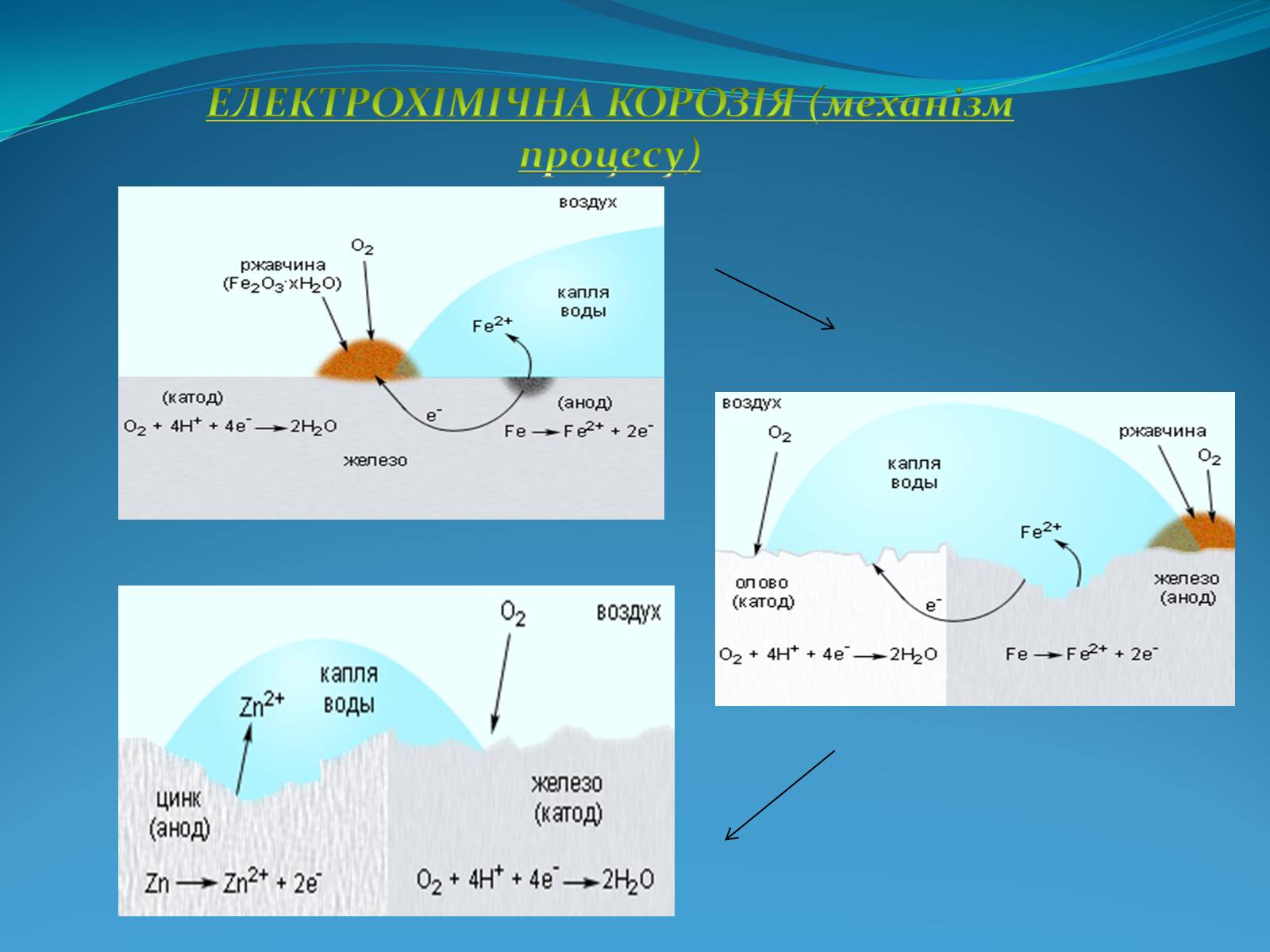
ЕЛЕКТРОХІМІЧНА КОРОЗІЯ (механізм процесу)
Слайд #14
СПОСОБИ ЗАХИСТУ ВІД КОРОЗІЇ
Нанесення захисних покриттів (лаки, фарби, емалі);
Покриття іншим металом(позолота, сріблення, хромування, цинкування);
Створення і використання антикорозійних сплавів
Введення в середу інгібіторів, що знижують агресивність середовища;
Протекторний захист
Нанесення захисних покриттів (лаки, фарби, емалі);
Покриття іншим металом(позолота, сріблення, хромування, цинкування);
Створення і використання антикорозійних сплавів
Введення в середу інгібіторів, що знижують агресивність середовища;
Протекторний захист
