- Головна
- Готові шкільні презентації
- Презентація на тему «Белки» (варіант 2)
Презентація на тему «Белки» (варіант 2)
148
Слайд #1
Белки
Презентация ученицы 11-П классаМихеевой Анастасии
Презентация ученицы 11-П классаМихеевой Анастасии

Слайд #2
Что такое белки?
Белками называют высокомолекулярные (молекулярная масса варьирует от 5-10 тыс. до 1 млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединённых амидной (пептидной) связью.
Белками называют высокомолекулярные (молекулярная масса варьирует от 5-10 тыс. до 1 млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединённых амидной (пептидной) связью.

Слайд #3
Строение
В молекулах белка α - аминокислоты связаны между собой пептидными
(-СO-NH-) связями
Большую роль в создании структуры белков играют ионные (солевые) и водородные связи, а также гидрофобное взаимодействие
Некоторые белки содержат в небольших количествах фосфор, селен и другие элементы
В молекулах белка α - аминокислоты связаны между собой пептидными
(-СO-NH-) связями
Большую роль в создании структуры белков играют ионные (солевые) и водородные связи, а также гидрофобное взаимодействие
Некоторые белки содержат в небольших количествах фосфор, селен и другие элементы

Слайд #4
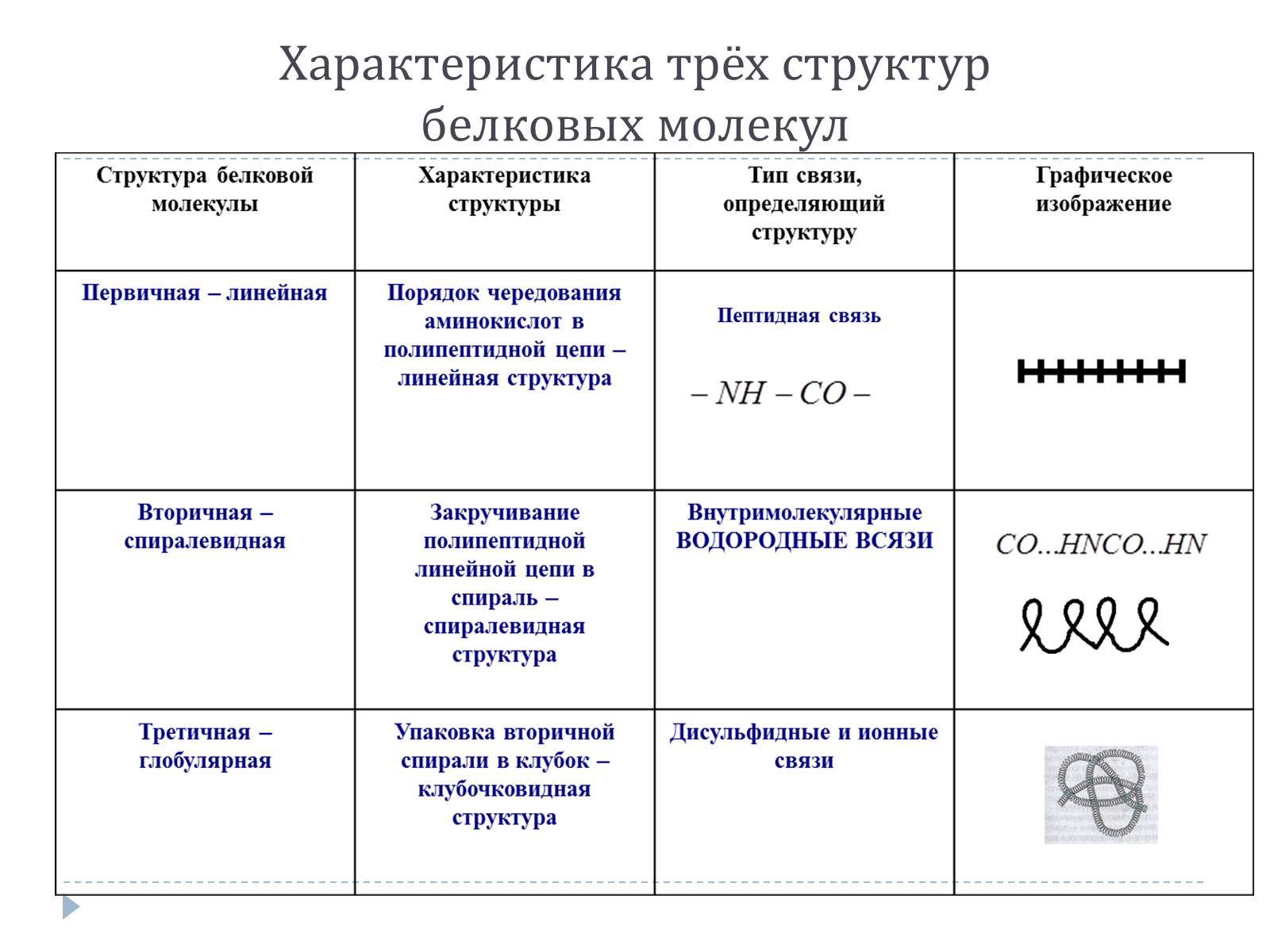
Последовательность соединения аминокислотных остатков в полипептидной цепи получила название первичной структурой белка.
Вторичной структурой обладает большая часть белков, правда, не всегда на всём протяжении полипептидной цепи
Вторичной структурой обладает большая часть белков, правда, не всегда на всём протяжении полипептидной цепи

Слайд #5
В формировании третичной структуры, кроме водородных связей, большую роль играет ионное и гидрофобное взаимодействие. По характеры «упаковки» белковой молекулы различают глобулярные, или шаровидные, и фибриллярные, или нитевидные, белки.

Слайд #6
В ряде случаев отдельные субъединицы белка с помощью водородных связей, электростатического и других взаимодействий образуют сложные ансамбли. В этом случае образуется четвертичная структура белков.

Слайд #7
Характеристика трёх структурбелковых молекул
Слайд #8
Свойства
Белки – амфотерные электролиты. При определённом значении рН среды (она называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково. Это одной из свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения их из растворов, например в технологии получения белковых продуктов.
Белки – амфотерные электролиты. При определённом значении рН среды (она называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково. Это одной из свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения их из растворов, например в технологии получения белковых продуктов.

Слайд #9
Горение
Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жжёных перьев.
Цветные реакции
ксантопротеиновую, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением жёлтой окраски;
биуретовую, при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди(II) с образованием комплексных соединений между ионами Cu2+ и полипептидами. Реакция
Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жжёных перьев.
Цветные реакции
ксантопротеиновую, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением жёлтой окраски;
биуретовую, при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди(II) с образованием комплексных соединений между ионами Cu2+ и полипептидами. Реакция

Слайд #10
Биологические функции белков
каталитические (ферменты);
регуляторные (гормоны);
структурные (коллаген, фиброин);
двигательные (миозин);
транспортные (гемоглобин, миоглобин);
защитные (иммуноглобулины, интерферон);
запасные (казеин, альбумин, глиадин).
Среди белков встречаются антибиотики и вещества, оказывающие токсическое действие.
каталитические (ферменты);
регуляторные (гормоны);
структурные (коллаген, фиброин);
двигательные (миозин);
транспортные (гемоглобин, миоглобин);
защитные (иммуноглобулины, интерферон);
запасные (казеин, альбумин, глиадин).
Среди белков встречаются антибиотики и вещества, оказывающие токсическое действие.

Слайд #11
Химический составорганизма человека
ВОДА – 65%
ЖИРЫ – 10%
БЕЛКИ – 18%
УГЛЕВОДЫ – 5%
Другие неорганические и органические вещества – 2%
ВОДА – 65%
ЖИРЫ – 10%
БЕЛКИ – 18%
УГЛЕВОДЫ – 5%
Другие неорганические и органические вещества – 2%
